Як розставляти коефіцієнти у хімічних рівняннях? Хімічні рівняння. Урок з хімії на тему "Розстановка коефіцієнтів в рівняннях хімічних реакцій" (8 кл.)
В уроці 13 «» з курсу « Хімія для чайників» Розглянемо навіщо потрібні хімічні рівняння; навчимося зрівнювати хімічні реакції, шляхом правильного розміщення коефіцієнтів. Даний урок вимагатиме від вас знання хімічних основ із минулих уроків. Обов'язково прочитайте про елементний аналіз, де докладно розглянуто емпіричні формули та аналіз хімічних речовин.
В результаті реакції горіння метану CH 4 в кисні O 2 утворюються діоксид вуглецю CO 2 і вода H 2 O. Ця реакція може бути описана хімічним рівнянням:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Спробуємо витягти з хімічного рівняння більше відомостей, ніж просто вказівку продуктів та реагентівреакції. Хімічні рівняння (1) є НЕповним і тому не дає жодних відомостей про те, скільки молекул O 2 витрачається в розрахунку на 1 молекулу CH 4 і скільки молекул CO 2 і H2 O виходить в результаті. Але якщо записати перед відповідними молекулярними формулами чисельні коефіцієнти, які вкажуть скільки молекул кожного сорту бере участь у реакції, ми отримаємо повне хімічне рівнянняреакції.
Для того, щоб завершити складання хімічного рівняння (1), потрібно пам'ятати одне просте правило: у лівій та правій частинахрівняння має бути однакове число атомів кожного сорту, оскільки в ході хімічної реакції не виникає нових атомів і не відбувається знищення наявних. Це правило ґрунтується на законі збереження маси, який ми розглянули на початку глави.
Потрібно для того, щоби з простого хімічного рівняння отримати повне. Отже, перейдемо до безпосереднього зрівнювання реакції (1): ще раз погляньте на хімічне рівняння, точно на атоми та молекули в правій та лівій частині. Неважко помітити, що у реакції беруть участь атоми трьох сортів: вуглець C, водень H та кисень O. Давайте підрахуємо та порівняємо кількість атомів кожного сорту у правій та лівій частині хімічного рівняння.

Почнемо із вуглецю. У лівій частині один атом входить до складу молекули CH 4 , а в правій частині один атом входить до складу CO 2 . Таким чином у лівій та у правій частині кількість атомів вуглецю збігається, тому його ми даємо спокій. Але для наочності поставимо коефіцієнт 1 перед молекулами з вуглецем, хоч це не обов'язково:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Потім переходимо до підрахунку атомів водню H. У лівій частині присутні 4 атоми H (у кількісному сенсі H 4 = 4H) у складі молекули CH 4 , а в правій – всього 2 атоми H у складі молекули H 2 O, що вдвічі менше ніж у лівій частині хімічного рівняння (2). Зрівнятимемо! Для цього поставимо коефіцієнт 2 перед молекулою H 2 O. Ось тепер у нас і в реагентах і продуктах буде по 4 молекули водню H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Зверніть увагу, що коефіцієнт 2, який ми записали перед молекулою води H 2 O для зрівнювання водню H, збільшує в 2 рази всі атоми, що входять до її складу, тобто 2H 2 O означає 4H і 2O. Гаразд, з цим начебто розібралися, залишилося підрахувати та порівняти кількість атомів кисню O у хімічному рівнянні (3). Відразу впадає в око, що в лівій частині атомів O рівно в 2 рази менше ніж у правій. Тепер ви вже й самі вмієте зрівнювати хімічні рівняння, тому одразу запишу фінальний результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O або СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Як бачите, зрівняння хімічних реакційне така вже й складна штука, і важлива тут не хімія, а математика. Рівняння (4) називається повним рівняннямхімічної реакції, оскільки у ньому дотримується закон збереження маси, тобто. Число атомів кожного сорту, що вступають у реакцію, точно збігається з числом атомів даного сорту після завершення реакції. У кожній частині цього повного хімічного рівняння міститься по 1 атому вуглецю, по 4 атоми водню та по 4 атоми кисню. Однак варто розуміти пару важливих моментів: хімічна реакція - це складна послідовність окремих проміжних стадій, і тому не можна, наприклад, тлумачити рівняння (4) у тому сенсі, що 1 молекула метану повинна одночасно зіткнутися з 2 молекулами кисню. Процеси, що відбуваються при утворенні продуктів реакції, набагато складніше. Другий момент: повне рівнянняреакції нічого не говорить нам про її молекулярний механізм, тобто про послідовність подій, що відбуваються на молекулярному рівні при її перебігу.
Коефіцієнти у рівняннях хімічних реакцій
Ще один наочний приклад того, як правильно розставити коефіцієнтив рівняннях хімічних реакцій: Тринітротолуол (ТНТ) C 7 H 5 N 3 O 6 енергійно з'єднується з киснем, утворюючи H 2 O, CO 2 та N 2 . Запишемо рівняння реакції, яке зрівнюватимемо:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Найпростіше складати повне рівняння, виходячи з двох молекул ТНТ, тому що в лівій частині міститься непарне число атомів водню та азоту, а в правій — парне:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тоді ясно, що 14 атомів вуглецю, 10 атомів водню та 6 атомів азоту повинні перетворитися на 14 молекул діоксиду вуглецю, 5 молекул води та 3 молекули азоту:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Тепер обох частинах міститься однакове число всіх атомів, крім кисню. З 33 атомів кисню, що є у правій частині рівняння, 12 поставляються двома вихідними молекулами ТНТ, а решта 21 повинні бути поставлені 105 молекулами O 2 . Таким чином повне хімічне рівняння матиме вигляд:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можна помножити обидві частини на 2 і позбутися нецілочисельного коефіцієнта 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Але цього можна і не робити, оскільки всі коефіцієнти рівняння не обов'язково мають бути цілими. Правильніше навіть скласти рівняння, виходячи з однієї молекули ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Повне хімічне рівняння (9) несе багато інформації. Насамперед воно вказує вихідні речовини. реагенти, а також продуктиреакції. Крім того, воно показує, що під час реакції індивідуально зберігаються всі атоми кожного сорту. Якщо помножити обидві частини рівняння (9) на число Авогадро N A =6,022·10 23 , ми зможемо стверджувати, що 4 молячи ТНТ реагують з 21 молями O 2 з утворенням 28 молей CO 2 , 10 молей H 2 O і 6 молей N 2 .
Є ще одна фішка. За допомогою таблиці Менделєєва визначаємо молекулярні маси всіх цих речовин:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Тепер рівняння 9 вкаже ще, що 4 227,13 г = 908,52 г ТНТ вимагають для здійснення повної реакції 21 · 31,999 г = 671,98 г кисню і в результаті утворюється 28 · 44,010 г = 1232,3 г CO 2 , 10 · 18,015 г = 180,15 г H 2 O і 6 · 28,013 г = 162,08 г . Перевіримо, чи виконується у цій реакції закон збереження маси:
| Реагенти | Продукти | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Разом | 1580,5 г | 1580,5 г |
Але необов'язково у хімічній реакції мають брати участь індивідуальні молекули. Наприклад, реакція вапняку CaCO3 та соляної кислоти HCl, з утворенням водного розчину хлориду кальцію CaCl2 та діоксиду вуглецю CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Хімічне рівняння (11) описує реакцію карбонату кальцію CaCO 3 (вапняку) та хлористоводневої кислоти HCl з утворенням водного розчину хлориду кальцію CaCl 2 та діоксиду вуглецю CO 2 . Це рівняння повне, тому що число атомів кожного сорту в його лівій та правій частинах однаково.
Сенс цього рівняння на макроскопічному (молярному) рівнітакий: 1 моль або 100,09 г CaCO 3 вимагає для здійснення повної реакції 2 моля або 72,92 г HCl, в результаті чого виходить по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г /моль) та H 2 O (18,02 г/моль). За цими чисельними даними неважко переконатися, що у цій реакції виконується закон збереження маси.
Інтерпретація рівняння (11) на мікроскопічному (молекулярному) рівніне настільки очевидна, оскільки карбонат кальцію є сіль, а не молекулярна сполука, а тому не можна розуміти хімічне рівняння (11) у тому сенсі, що 1 молекула карбонату кальцію CaCO 3 реагує з 2 молекулами HCl. Тим більше, молекула HCl в розчині взагалі дисоціює (розпадається) на іони H + і Cl - . Таким чином більше правильним описомтого, що відбувається в цій реакції на молекулярному рівні, дає рівняння:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (р.) + H 2 O(ж.) (12)
Тут у дужках скорочено зазначено фізичний стан кожного сорту частинок ( тб.- Тверде, водн.- гідратований іон у водному розчині, м.- газ, ж.- Рідина).
Рівняння (12) показує, що твердий CaCO 3 реагує з двома гідратованими іонами H + утворюючи при цьому позитивний іон Ca 2+ , CO 2 і H 2 O. Рівняння (12) як і інші повні хімічні рівняння не дає уявлення про молекулярний механізм реакції і менш зручно для підрахунку кількості речовин, проте, воно дає кращий описщо відбувається на мікроскопічному рівні.
Закріпіть отримані знання про складання хімічних рівнянь, самостійно розібравши приклад із розв'язанням:
Сподіваюся з уроку 13 Упорядкування хімічних рівнянь» Ви дізналися для себе щось нове. Якщо у вас виникли запитання, пишіть їх у коментарі.
Інструкція
Перш ніж приступати до завдання, потрібно засвоїти, що цифра, яка ставиться перед хімічним елементом або всією формулою коефіцієнтом. А цифра, що стоїть (і трохи) індекс. Крім цього , що:
Коефіцієнт відноситься до всіх хімічних символів, що стоять після нього у формулі
Коефіцієнт множиться на індекс (не складається!)
Атомів кожного елемента речовин, що вступають у реакцію, має збігатися з числом атомів цих елементів, що входять до продуктів реакції.
Наприклад, запис формули 2H2SO4 означає 4 атоми H (водню), 2 атоми S (сірки) та 8 атомів O (кисню).
1. Приклад № 1. Розглянемо горіння етилену.
При згорянні органічної речовиниутворюються оксид вуглецю (IV) (вуглекислий газ) та вода. Спробуємо послідовно коефіцієнти.
C2H4 + O2 => CO2+ H2O
Починаємо аналізувати. У реакцію вступило 2 атоми С (вуглецю), а вийшов тільки 1 атом, значить перед CO2 ставимо 2. Тепер їх кількість однакова.
C2H4 + O2 => 2CO2+ H2O
Тепер дивимося на H (водень). У реакцію вступило 4 атоми водню, а вийшло в результаті лише 2 атоми, отже, перед H2O (водою) ставимо 2 – тепер вийшло теж 4
C2H4 + O2 => 2CO2+ 2H2O
Вважаємо всі атоми О (кисню), що утворилися в результаті реакції (тобто після рівності). 4 атоми в 2CO2 і 2 атоми в 2H2O - всього 6 атомів. А до реакції всього 2 атоми, отже, перед молекулою кисню O2 ставимо 3, отже, їх стало теж 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким чином, вийшла однакова кількість атомів кожного елемента до знаку рівності.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Приклад № 2. Розглянемо реакцію взаємодії алюмінію з розведеною сірчаною кислотою.
Al + H2SO4 => Al2 (SO4) 3 + H2
Дивимося на атоми S, що входять до складу Al2 (SO4) 3 - їх 3, а H2SO4 (сірчаної кислоти) тільки 1, отже, і перед сірчаною кислотою теж ставимо 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зате тепер вийшло до реакції 6 атомів H (водню), а після реакції лише 2, отже, перед молекулою H2 (водню) ставимо також 3, щоб у цілому вийшло 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В останню чергу дивимося на . Так як Al2 (SO4) 3 (сульфаті алюмінію) всього 2 атома алюмінію, то і до реакції перед Al (алюмінієм) ставимо 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Тепер кількість всіх атомів до реакції і після реакції збігається. Виявилося, що розставляти коефіцієнти в хімічних рівнянняхне так і складно. Достатньо потренуватися і все вийде.
Обов'язково враховуйте, що коефіцієнт множиться на індекс, а чи не складається.
Джерела:
- як елементи вступають у реакцію
- Тест на тему «Хімічні рівняння»
Для багатьох школярів написати рівняння хімічних реакцій та правильно розставити коефіцієнтинелегке завдання. Причому головну трудність у них чомусь викликає саме друга її частина. Здавалося б, нічого складного в тому немає, проте часом учні пасують, впадаючи в повну розгубленість. Адже треба лише запам'ятати кілька простих правил, і завдання перестане викликати труднощі.
Інструкція
Коефіцієнт, тобто число, яке стоїть перед формулою молекули хімічної речовини, до всіх символів, та множиться на кожен кожного символу! Саме множиться, а не складається! Це може здатися неймовірним, але деякі школярі складають два числа замість того, щоб їх перемножити.
Кількість атомів кожного елемента вихідних речовин (тобто що у лівої частини рівняння) має збігатися з кількістю атомів кожного елемента продуктів реакції (відповідно, що у його правої частини).
Рівнянням реакції у хімії називається запис хімічного процесу за допомогою хімічних формул та математичних знаків.
Такий запис є схемою хімічної реакції. Коли виникає знак «=», це називається «рівняння». Спробуємо його вирішити.
Приклад розбору простих реакцій
У кальції один атом, оскільки коефіцієнт не вартий. Індекс тут теж не написаний, отже, одиниця. З правого боку рівняння Са також один. За кальцієм нам не треба працювати.
Дивимося наступний елемент – кисень. Індекс 2 говорить про те, що тут 2 іони кисню. З правого боку немає індексів, тобто одна частка кисню, і з лівої – 2 частки. Що ми робимо? Жодних додаткових індексів або виправлень до хімічної формули вносити не можна, оскільки вона написана правильно.
Коефіцієнти – те, що написано перед найменшою частиною. Вони мають право змінюватись. Для зручності саму формулу не переписуємо. З правої частини один множимо на 2, щоб отримати і там 2 іони кисню.

Після того, як ми поставили коефіцієнт, вийшло 2 атоми кальцію. З лівого боку лише один. Отже, тепер перед кальцієм ми маємо поставити 2.

Тепер перевіряємо підсумок. Якщо кількість атомів елементів дорівнює з обох сторін, можемо поставити знак «рівно».

Інший наочний приклад: два водні ліворуч, і після стрілочки у нас теж два водні.

- Два кисні до стрілочки, а після стрілочки індексів немає, отже, один.
- Зліва більше, а праворуч менше.
- Ставимо коефіцієнт 2 перед водою.

Помножили всю формулу на 2 і тепер у нас змінилася кількість водню. Помножуємо індекс на коефіцієнт, і виходить 4. А з лівого боку залишилося два атоми водню. І щоб отримати 4, ми повинні водень помножити на два.

Ось той випадок, коли елемент в одній і іншій формулі з одного боку, до стрілочки.

Один іон сірки зліва, і один іон – праворуч. Дві частинки кисню плюс ще дві частинки кисню. Значить, що з лівого боку 4 кисні. Праворуч знаходиться 3 кисні. Тобто з одного боку виходить парне число атомів, з другого – непарне. Якщо ж ми помножимо непарне вдвічі, то отримаємо парне число. Доводимо спочатку до парного значення. Для цього множимо на два всю формулу після стрілочки. Після множення отримуємо шість іонів кисню та ще й 2 атоми сірки. Зліва ж маємо одну мікрочастинку сірки. Тепер зрівняємо її. Ставимо зліва рівняння перед сіркою 2.

Зрівняли.
Складні реакції
Цей приклад складніший, тому що тут більше елементів речовини.

Це називається реакцією нейтралізації. Що тут потрібно зрівнювати насамперед:
- Зліва один атом натрію.
- З правого боку індекс свідчить, що тут 2 натрію.
Напрошується висновок, що треба помножити всю формулу на два.

Тепер дивимося, скільки сірки. З лівого та правого боку по одній. Звертаємо увагу на кисень. З лівого боку маємо 6 атомів кисню. З іншого боку – 5. Менше праворуч, більше ліворуч. Непарна кількістьтреба довести до парного значення. Для цього формулу води множимо на 2, тобто із одного атома кисню робимо 2.
Тепер із правого боку вже 6 атомів кисню. З лівого боку також 6 атомів. Перевіряємо водень. Два атоми водню та ще 2 атоми водню. Тобто буде чотири атоми водню з лівого боку. І з іншого боку також чотири атоми водню. Усі елементи зрівняні. Ставимо знак "рівно".

Наступний приклад.

Тут приклад цікавий тим, що з'явилися дужки. Вони говорять про те, що якщо множник стоїть за дужкою, то кожен елемент, що стоїть у дужках, множиться на нього. Почати необхідно з азоту, тому що його менше, ніж кисню та водню. Ліворуч азот один, а праворуч, з урахуванням дужок, його два.

Праворуч два атоми водню, а потрібно чотири. Ми виходимо зі становища, просто помножуючи воду на два, внаслідок чого отримали чотири водні. Добре, водень зрівняли. Залишився кисень. До реакції присутні 8 атомів, після – теж 8.
Добре, всі елементи зрівняні, можемо ставити «рівно».

Останній приклад.

На черзі у нас є барій. Він зрівняний, його чіпати не треба. До реакції присутні два хлори, після неї – лише один. Що потрібно зробити? Поставити 2 перед хлором після реакції.

Тепер за рахунок коефіцієнта, який щойно поставлено, після реакції вийшло два натрію, і до реакції теж два. Добре, все інше зрівняно.

Також вирівнювати реакції можна методом електронного балансу. Цей метод має низку правил, за якими його можна здійснювати. Наступною дією ми повинні розставити ступеня окислення всіх елементів у кожній речовині для того, щоб зрозуміти, де відбулося окислення, а де відновлення.
Існує кілька методів визначення коефіцієнтів у рівняннях окисно-відновних реакцій. Ми використовуємо метод електронного балансу, у якому складання повного рівняння ОВР проводиться у наступній последовательности:
1. Складають схему реакції, вказавши речовини, що вступили в реакцію, та речовини, що вийшли в результаті реакції, наприклад:
2. Визначають ступінь окислення атомів та пишуть її знак і величину над символами елементів, відзначаючи елементи, ступінь окислення яких змінився:
3. Записують електронні рівняння реакцій окислення та відновлення, визначають кількість електронів, відданих відновником і прийнятих окислювачем, а потім зрівнюють їх, помножуючи на відповідні коефіцієнти:
4. Отримані коефіцієнти, що відповідають електронному балансу, переносять у основне рівняння:
5. Зрівнюють число атомів та іонів, що не змінюють ступеня окислення (у послідовності: метали, неметали, водень):
6. Перевіряють правильність підбору коефіцієнтів за кількістю атомів кисню в лівій та правій частині рівняння реакції – вони мають бути рівними (у цьому рівнянні 24 = 18 + 2 + 4, 24 = 24).
Розглянемо складніший приклад:
Визначимо ступеня окиснення атомів у молекулах:
Складемо електронні рівняння реакцій окислення та відновлення та зрівняємо кількість відданих та прийнятих електронів:
Перенесемо коефіцієнти в основне рівняння:
Зрівняємо число атомів, що не змінюють ступінь окислення:
Підрахувавши число атомів кисню у правій та лівій частині рівняння, переконаємось, що коефіцієнти підібрані правильно.
Найважливіші окислювачі та відновники
Окисно-відновні властивості елементів залежать від будови електронної оболонки атомів і визначаються їх становищем у періодичній системі Менделєєва.
Метали, маючи на зовнішньому енергетичному рівні 1-3 електрони, легко їх віддають і виявляють лише відновлювальні властивості. Неметали (елементи IV-VII груп) можуть як віддавати, так і приймати електрони, тому вони можуть виявляти і відновлювальні та окисні властивості. У періоди зі збільшенням порядкового номера елемента відновлювальні властивості простих речовин слабшають, а окислювальні посилюються. У групах із підвищенням порядкового номера відновлювальні властивості посилюються, а окисні слабшають. Таким чином, з простих речовин найкращими відновниками є лужні метали, Алюміній, водень, вуглець; кращими окислювачами є галогени та кисень.
Окисно-відновні властивості складних речовин залежать від ступеня окислення атомів, що входять до їх складу. Речовини, що містять атоми з нижчим ступенем окиснення, виявляють відновлювальні властивості. Найважливішими відновниками є оксид вуглецю  , сірководень
, сірководень  сульфат заліза(II)
сульфат заліза(II)  .Речовини, до складу яких входять атоми з вищим ступенем окиснення, виявляють окисні властивості. Найважливішими окислювачами є перманганат калію.
.Речовини, до складу яких входять атоми з вищим ступенем окиснення, виявляють окисні властивості. Найважливішими окислювачами є перманганат калію.  , дихромат калію
, дихромат калію  , перекис водню
, перекис водню  ,
азотна кислота
,
азотна кислота концентрована сірчана кислота
концентрована сірчана кислота  .
.
Речовини, що містять атоми з проміжним ступенем окислення, можуть поводитися як окислювачі або відновникизалежно від властивостей речовин, з якими вони взаємодіють, та умов перебігу реакції. Так у реакції з  сірчиста кислота виявляє відновлювальні властивості:
сірчиста кислота виявляє відновлювальні властивості:
а при взаємодії із сірководнем є окислювачем:

Крім того, для таких речовин можливі реакції самоокислення-самовосстановлення, що протікають з одночасним збільшенням та зменшенням ступеня окислення атомів одного і того ж елемента, наприклад:
Сила багатьох окислювачів та відновників залежить від рН середовища. Наприклад, 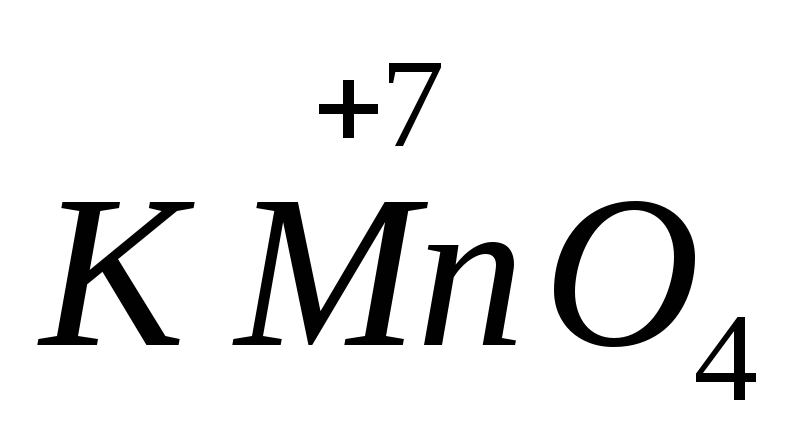 у лужному середовищі відновлюється до
у лужному середовищі відновлюється до  , в нейтральній до
, в нейтральній до  , у присутності сірчаної кислоти - до
, у присутності сірчаної кислоти - до  .
.
Сьогодні ми поговоримо про те, як розставляти коефіцієнти у хімічних рівняннях. Дане питання цікавить не тільки старшокласників загальноосвітніх установ, а й хлопців, які лише знайомляться з основними елементами складної та цікавої науки. Якщо на першому етапі зрозуміти, у майбутньому проблем із розв'язанням задач не з'явиться. Давайте розбиратися з самого початку.
Що таке рівняння
Під ним прийнято мати на увазі умовний запис хімічної реакції, що протікає між вибраними реагентами. Для такого процесу використовують індекси, коефіцієнти, формули.
Алгоритм складання
Як оформити хімічні рівняння? Приклади будь-яких взаємодій можна написати, підсумовуючи вихідні сполуки. Знак рівності свідчить про те, що між речовинами, що реагують, протікає взаємодія. Далі складається формула продуктів за валентністю (ступеня окиснення).
Як записати реакцію
Наприклад, якщо потрібно записати хімічні рівняння, що підтверджують властивості метану, вибираємо такі варіанти:
- галогенування (радикальна взаємодія з елементом VIIA періодичної таблиці Д. І. Менделєєва);
- горіння в кисні повітря.
Для першого випадку у лівій частині пишемо вихідні речовини, у правій – отримані продукти. Після перевірки числа атомів кожного хімічного елемента отримуємо кінцевий запис процесу, що відбувається. При горінні метану в кисні повітря відбувається екзотермічний процес, в результаті якого утворюється вуглекислий газ та водяна пара.
Щоб правильно поставити коефіцієнти в хімічних рівняннях, використовується закон збереження маси речовин. Починаємо процес зрівнювання з визначення кількості атомів вуглецю. Далі проводимо розрахунки для водню і лише після цього перевіряємо кількість кисню.
ОВР
Складні хімічні рівняння можна зрівняти, озброївшись методом електронного балансу чи напівреакцій. Пропонуємо послідовність дій, призначену для розміщення коефіцієнтів у реакціях наступних типів:
- розкладання;
- заміщення.

Спочатку важливо розставити у кожного елемента у поєднанні ступеня окиснення. При їх розміщенні необхідно враховувати деякі правила:
- У простої речовинивона дорівнює нулю.
- У бінарному з'єднанні їхня сума дорівнює 0.
- У поєднанні з трьох і більше елементів у першого проявляється позитивна величина, у крайнього іона - негативне значенняступеня окиснення. Центральний елемент вираховують математичним шляхом, враховуючи, що у сумі має бути 0.
Далі вибирають ті атоми чи іони, які змінили показник ступеня окислення. Знаками "плюс" та "мінус" показують кількість електронів (прийнятих, відданих). Далі з-поміж них визначається найменше кратне. При поділі НОК на ці цифри одержують числа. Даний алгоритм і буде відповіддю на питання, як розставляти коефіцієнти в хімічних рівняннях.
Перший приклад
Припустимо, дано завдання: «Розставте коефіцієнти реакції, доповніть пропуски, визначте окислювач і відновник». Такі приклади пропонуються випускникам школи, які обрали хімію як ЄДІ.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Спробуємо зрозуміти, як розставляти коефіцієнти в хімічних рівняннях, які пропонують майбутнім інженерам і медикам. Після розстановки ступенів окислення у елементів у вихідних речовинах і наявних продуктах отримуємо, що як окислювач виступає іон марганцю, а відновлювальні властивості демонструє бромід-іон.
Робимо висновок про те, що пропущені речовини не беруть участь в окисно-відновному процесі. Одним із відсутніх продуктів є вода, а другим стане сульфат калію. Після складання електронного балансу завершальним етапом стане встановлення коефіцієнтів у рівнянні.
Другий приклад
Наведемо ще один приклад, щоб зрозуміти, як розставляти коефіцієнти в хімічних рівняннях окисно-відновного виду.
Допустимо, дана наступна схема:
P + HNO 3 = NO 2 + … + …
Фосфор, який за умовою є простою речовиною, виявляє відновлювальні властивості, підвищуючи рівень окислення до +5. Тому однією з пропущених речовин буде фосфорна кислота H 3 PO 4. ОВР передбачає наявність відновника, яким виступатиме азот. Він перетворюється на оксид азоту (4), утворюючи NO 2

Щоб поставити у цій реакції коефіцієнти, складемо електронний баланс.
P 0 віддає 5e = P +5
N+5 приймає e=N+4
Враховуючи, що перед азотною кислотою та оксидом азоту (4) повинен стояти коефіцієнт 5, отримуємо готову реакцію:
P + 5HNO 3 =5NO 2 + H 2 O + H 3 PO 4
Стереохімічні коефіцієнти хімії дозволяють вирішувати різноманітні розрахункові завдання.
Третій приклад
Враховуючи, що розташування коефіцієнтів викликає у багатьох старшокласників труднощі, необхідно відпрацьовувати послідовність дій на конкретних прикладах. Пропонуємо ще один приклад завдання, виконання якого передбачає володіння методикою розміщення коефіцієнтів в окислювально-відновній реакції.
H 2 S + HMnO 4 = S + MnO 2 +…

Особливість запропонованого завдання у цьому, що потрібно доповнити пропущений продукт реакції і тільки після цього можна переходити до постановки коефіцієнтів.
Після розміщення ступенів окислення у кожного елемента в сполуках можна зробити висновок, що окисні властивостівиявляє марганець, що знижує валентність. Відновну здатність запропонованої реакції демонструє сірка, відновлюючись до простої речовини. Після складання електронного балансу нам залишиться лише розставити коефіцієнти у запропоновану схему процесу. І справа зроблена.
Четвертий приклад
Хімічне рівняння називають повним процесом у тому випадку, коли в ньому повному обсязідотримується закону збереження маси речовин. Як перевірити цю закономірність? Кількість атомів одного виду, які вступили в реакцію, має відповідати їх числу у продуктах взаємодії. Тільки в цьому випадку можна буде вести мову про повноцінність записаної хімічної взаємодії, можливості її застосування для проведення обчислень, вирішення розрахункових завдань. різного рівняскладності. Наведемо варіант завдання, що передбачає розстановку реакції відсутніх стереохімічних коефіцієнтів:
Si + … + HF = H 2 SiF 6 + NO + …

Складність завдання полягає в тому, що пропущені і вихідні речовини, і продукти взаємодії. Після встановлення всіх елементів ступенів окислення бачимо, що відновлювальні властивості виявляє в запропонованому завданні атом кремнію. Серед продуктів реакції присутній азот (II), однією з вихідних сполук є азотна кислота. Логічним шляхом визначаємо, що відсутнім продуктом реакції є вода. Завершальним етапом буде розстановка отриманих стереохімічних коефіцієнтів реакцію.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Приклад завдання рівняння
Потрібно визначити обсяг 10% розчину хлороводню, щільність якого становить 1,05 г/мл, необхідний для повної нейтралізації гідроксиду кальцію, що утворюється в процесі гідролізу карбіду. Відомо, що газ, що виділяється в ході гідролізу, займає об'єм 8,96 л (н. у.).
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
Гідроксид кальцію вступає у взаємодію з хлороводнем, відбувається повна нейтралізація:
Ca(OH) 2 + 2HCl = CaCl 2 + 2H 2 O

Обчислюємо масу кислоти, яка буде потрібна для даного процесу. Визначаємо об'єм розчину хлороводню. Усі розрахунки за завданням проводяться з урахуванням стереохімічних коефіцієнтів, що підтверджує їх важливість.
На закінчення
Аналіз результатів єдиного державного іспитуз хімії свідчить про те, що завдання, пов'язані з постановкою стереохімічних коефіцієнтів у рівняннях, складання електронного балансу, визначення окислювача та відновника викликають серйозні труднощі у сучасних випускників загальноосвітніх шкіл. На жаль, ступінь самостійності сучасних випускників практично мінімальний, тому відпрацювання теоретичної бази, запропонованої педагогом, старшокласники не проводять.
Серед типових помилок, які допускають школярі, розставляючи коефіцієнти у реакціях різного типубагато математичних похибок. Наприклад, в повному обсязі вміють знаходити найменше загальне кратне, правильно ділити і множити числа. Причина подібного явища у зменшенні кількості годин, виділених у освітніх школахвивчення цієї теми. При базовій програміз хімії у педагогів немає можливості відпрацьовувати зі своїми школярами питання щодо складання електронного балансу в окислювально-відновлювальному процесі.