Чи легко розставляти коефіцієнти у хімічних рівняннях.
В уроці 13 «» з курсу « Хімія для чайників» Розглянемо навіщо потрібні хімічні рівняння; навчимося зрівнювати хімічні реакції, шляхом правильного розміщення коефіцієнтів. Даний урок вимагатиме від вас знання хімічних основ із минулих уроків. Обов'язково прочитайте про елементний аналіз, де докладно розглянуто емпіричні формули та аналіз хімічних речовин.
В результаті реакції горіння метану CH 4 в кисні O 2 утворюються діоксид вуглецю CO 2 і вода H 2 O. Ця реакція може бути описана хімічним рівнянням:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Спробуємо витягти з хімічного рівняння більше відомостей, ніж просто вказівку продуктів та реагентівреакції. Хімічні рівняння (1) є НЕповним і тому не дає жодних відомостей про те, скільки молекул O 2 витрачається в розрахунку на 1 молекулу CH 4 і скільки молекул CO 2 і H2 O виходить в результаті. Але якщо записати перед відповідними молекулярними формулами чисельні коефіцієнти, які вкажуть скільки молекул кожного сорту бере участь у реакції, ми отримаємо повне хімічне рівнянняреакції.
Для того, щоб завершити складання хімічного рівняння (1), потрібно пам'ятати одне просте правило: у лівій та правій частинахрівняння має бути однакове число атомів кожного сорту, оскільки в ході хімічної реакції не виникає нових атомів і не відбувається знищення наявних. Це правило ґрунтується на законі збереження маси, який ми розглянули на початку глави.
Потрібно для того, щоби з простого хімічного рівняння отримати повне. Отже, перейдемо до безпосереднього зрівнювання реакції (1): ще раз погляньте на хімічне рівняння, точно на атоми та молекули в правій та лівій частині. Неважко помітити, що у реакції беруть участь атоми трьох сортів: вуглець C, водень H та кисень O. Давайте підрахуємо та порівняємо кількість атомів кожного сорту у правій та лівій частині хімічного рівняння.
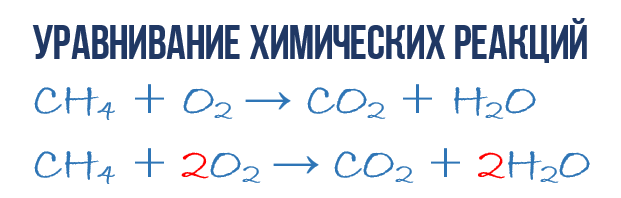
Почнемо із вуглецю. У лівій частині один атом входить до складу молекули CH 4 , а в правій частині один атом входить до складу CO 2 . Таким чином у лівій та у правій частині кількість атомів вуглецю збігається, тому його ми даємо спокій. Але для наочності поставимо коефіцієнт 1 перед молекулами з вуглецем, хоч це не обов'язково:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Потім переходимо до підрахунку атомів водню H. У лівій частині присутні 4 атоми H (у кількісному сенсі H 4 = 4H) у складі молекули CH 4 , а в правій – всього 2 атоми H у складі молекули H 2 O, що вдвічі менше ніж у лівій частині хімічного рівняння (2). Зрівнятимемо! Для цього поставимо коефіцієнт 2 перед молекулою H 2 O. Ось тепер у нас і в реагентах і продуктах буде по 4 молекули водню H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Зверніть увагу, що коефіцієнт 2, який ми записали перед молекулою води H 2 O для зрівнювання водню H, збільшує в 2 рази всі атоми, що входять до її складу, тобто 2H 2 O означає 4H і 2O. Гаразд, з цим начебто розібралися, залишилося підрахувати та порівняти кількість атомів кисню O у хімічному рівнянні (3). Відразу впадає в око, що в лівій частині атомів O рівно в 2 рази менше ніж у правій. Тепер ви вже й самі вмієте зрівнювати хімічні рівняння, тому одразу запишу фінальний результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O або СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Як бачите, вирівнювання хімічних реакцій не така вже й складна штука, і важлива тут не хімія, а математика. Рівняння (4) називається повним рівняннямхімічної реакції, оскільки у ньому дотримується закон збереження маси, тобто. Число атомів кожного сорту, що вступають у реакцію, точно збігається з числом атомів даного сорту після завершення реакції. У кожній частині цього повного хімічного рівняння міститься по 1 атому вуглецю, по 4 атоми водню та по 4 атоми кисню. Однак варто розуміти пару важливих моментів: хімічна реакція - це складна послідовність окремих проміжних стадій, і тому не можна, наприклад, тлумачити рівняння (4) у тому сенсі, що 1 молекула метану повинна одночасно зіткнутися з 2 молекулами кисню. Процеси, що відбуваються при утворенні продуктів реакції, набагато складніше. Другий момент: повне рівнянняреакції нічого не говорить нам про її молекулярний механізм, тобто про послідовність подій, що відбуваються на молекулярному рівні при її перебігу.
Коефіцієнти у рівняннях хімічних реакцій
Ще один наочний приклад того, як правильно розставити коефіцієнтив рівняннях хімічних реакцій: Тринітротолуол (ТНТ) C 7 H 5 N 3 O 6 енергійно з'єднується з киснем, утворюючи H 2 O, CO 2 та N 2 . Запишемо рівняння реакції, яке зрівнюватимемо:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Найпростіше складати повне рівняння, виходячи з двох молекул ТНТ, тому що в лівій частині міститься непарне число атомів водню та азоту, а в правій — парне:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тоді ясно, що 14 атомів вуглецю, 10 атомів водню та 6 атомів азоту повинні перетворитися на 14 молекул діоксиду вуглецю, 5 молекул води та 3 молекули азоту:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Тепер обох частинах міститься однакове число всіх атомів, крім кисню. З 33 атомів кисню, що є у правій частині рівняння, 12 поставляються двома вихідними молекулами ТНТ, а решта 21 повинні бути поставлені 105 молекулами O 2 . Таким чином повне хімічне рівняння матиме вигляд:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можна помножити обидві частини на 2 і позбутися нецілочисельного коефіцієнта 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Але цього можна і не робити, оскільки всі коефіцієнти рівняння не обов'язково мають бути цілими. Правильніше навіть скласти рівняння, виходячи з однієї молекули ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Повне хімічне рівняння (9) несе багато інформації. Насамперед воно вказує вихідні речовини. реагенти, а також продуктиреакції. Крім того, воно показує, що під час реакції індивідуально зберігаються всі атоми кожного сорту. Якщо помножити обидві частини рівняння (9) на число Авогадро N A =6,022·10 23 , ми зможемо стверджувати, що 4 молячи ТНТ реагують з 21 молями O 2 з утворенням 28 молей CO 2 , 10 молей H 2 O і 6 молей N 2 .
Є ще одна фішка. За допомогою таблиці Менделєєва визначаємо молекулярні маси всіх цих речовин:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Тепер рівняння 9 вкаже ще, що 4 227,13 г = 908,52 г ТНТ вимагають для здійснення повної реакції 21 · 31,999 г = 671,98 г кисню і в результаті утворюється 28 · 44,010 г = 1232,3 г CO 2 , 10 · 18,015 г = 180,15 г H 2 O і 6 · 28,013 г = 162,08 г . Перевіримо, чи виконується у цій реакції закон збереження маси:
| Реагенти | Продукти | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Разом | 1580,5 г | 1580,5 г |
Але необов'язково у хімічній реакції мають брати участь індивідуальні молекули. Наприклад, реакція вапняку CaCO3 та соляної кислоти HCl, з утворенням водного розчину хлориду кальцію CaCl2 та діоксиду вуглецю CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Хімічне рівняння (11) описує реакцію карбонату кальцію CaCO 3 (вапняку) та хлористоводневої кислоти HCl з утворенням водного розчину хлориду кальцію CaCl 2 та діоксиду вуглецю CO 2 . Це рівняння повне, тому що число атомів кожного сорту в його лівій та правій частинах однаково.
Сенс цього рівняння на макроскопічному (молярному) рівнітакий: 1 моль або 100,09 г CaCO 3 вимагає для здійснення повної реакції 2 моля або 72,92 г HCl, в результаті чого виходить по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г /моль) та H 2 O (18,02 г/моль). За цими чисельними даними неважко переконатися, що у цій реакції виконується закон збереження маси.
Інтерпретація рівняння (11) на мікроскопічному (молекулярному) рівніне настільки очевидна, оскільки карбонат кальцію є сіль, а не молекулярна сполука, а тому не можна розуміти хімічне рівняння (11) у тому сенсі, що 1 молекула карбонату кальцію CaCO 3 реагує з 2 молекулами HCl. Тим більше, молекула HCl в розчині взагалі дисоціює (розпадається) на іони H + і Cl - . Таким чином більше правильним описомтого, що відбувається в цій реакції на молекулярному рівні, дає рівняння:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (р.) + H 2 O(ж.) (12)
Тут у дужках скорочено зазначено фізичний стан кожного сорту частинок ( тб.- Тверде, водн.- гідратований іон у водному розчині, м.- газ, ж.- Рідина).
Рівняння (12) показує, що твердий CaCO 3 реагує з двома гідратованими іонами H + утворюючи при цьому позитивний іон Ca 2+ , CO 2 і H 2 O. Рівняння (12) як і інші повні хімічні рівняння не дає уявлення про молекулярний механізм реакції і менш зручно для підрахунку кількості речовин, проте, воно дає кращий описщо відбувається на мікроскопічному рівні.
Закріпіть отримані знання про складання хімічних рівнянь, самостійно розібравши приклад із розв'язанням:
Сподіваюся з уроку 13 Упорядкування хімічних рівнянь» Ви дізналися для себе щось нове. Якщо у вас виникли запитання, пишіть їх у коментарі.
Існує кілька методів визначення коефіцієнтів у рівняннях окисно-відновних реакцій. Ми використовуємо метод електронного балансу, у якому складання повного рівняння ОВР проводиться у наступній последовательности:
1. Складають схему реакції, вказавши речовини, що вступили в реакцію, та речовини, що вийшли в результаті реакції, наприклад:
2. Визначають ступінь окислення атомів та пишуть її знак і величину над символами елементів, відзначаючи елементи, ступінь окислення яких змінився:
3. Записують електронні рівняння реакцій окислення та відновлення, визначають кількість електронів, відданих відновником і прийнятих окислювачем, а потім зрівнюють їх, помножуючи на відповідні коефіцієнти:
4. Отримані коефіцієнти, що відповідають електронному балансу, переносять у основне рівняння:
5. Зрівнюють число атомів та іонів, що не змінюють ступеня окислення (у послідовності: метали, неметали, водень):
6. Перевіряють правильність підбору коефіцієнтів за кількістю атомів кисню в лівій та правій частині рівняння реакції – вони мають бути рівними (у цьому рівнянні 24 = 18 + 2 + 4, 24 = 24).
Розглянемо складніший приклад:
Визначимо ступеня окиснення атомів у молекулах:
Складемо електронні рівняння реакцій окислення та відновлення та зрівняємо кількість відданих та прийнятих електронів:
Перенесемо коефіцієнти в основне рівняння:
Зрівняємо число атомів, що не змінюють ступінь окислення:
Підрахувавши число атомів кисню у правій та лівій частині рівняння, переконаємось, що коефіцієнти підібрані правильно.
Найважливіші окислювачі та відновники
Окисно-відновні властивості елементів залежать від будови електронної оболонки атомів і визначаються їх становищем у періодичній системі Менделєєва.
Метали, маючи на зовнішньому енергетичному рівні 1-3 електрони, легко їх віддають і виявляють лише відновлювальні властивості. Неметали (елементи IV-VII груп) можуть як віддавати, так і приймати електрони, тому вони можуть виявляти і відновлювальні та окисні властивості. У періоди зі збільшенням порядкового номера елемента відновлювальні властивості простих речовин слабшають, а окислювальні посилюються. У групах із підвищенням порядкового номера відновлювальні властивості посилюються, а окисні слабшають. Таким чином, з простих речовин найкращими відновниками є лужні метали, Алюміній, водень, вуглець; кращими окислювачами є галогени та кисень.
Окисно-відновні властивості складних речовин залежать від ступеня окислення атомів, що входять до їх складу. Речовини, що містять атоми з нижчим ступенем окиснення, виявляють відновлювальні властивості. Найважливішими відновниками є оксид вуглецю  , сірководень
, сірководень  сульфат заліза(II)
сульфат заліза(II)  .Речовини, до складу яких входять атоми з вищим ступенем окиснення, виявляють окисні властивості. Найважливішими окислювачами є перманганат калію.
.Речовини, до складу яких входять атоми з вищим ступенем окиснення, виявляють окисні властивості. Найважливішими окислювачами є перманганат калію.  , дихромат калію
, дихромат калію  , перекис водню
, перекис водню  , азотна кислота
, азотна кислота  концентрована сірчана кислота
концентрована сірчана кислота  .
.
Речовини, що містять атоми з проміжним ступенем окислення, можуть поводитися як окислювачі або відновникизалежно від властивостей речовин, з якими вони взаємодіють, та умов перебігу реакції. Так у реакції з  сірчиста кислота виявляє відновлювальні властивості:
сірчиста кислота виявляє відновлювальні властивості:
а при взаємодії із сірководнем є окислювачем:

Крім того, для таких речовин можливі реакції самоокислення-самовосстановлення, що протікають з одночасним збільшенням та зменшенням ступеня окислення атомів одного і того ж елемента, наприклад:
Сила багатьох окислювачів та відновників залежить від рН середовища. Наприклад,  у лужному середовищі відновлюється до
у лужному середовищі відновлюється до  , в нейтральній до
, в нейтральній до  , у присутності сірчаної кислоти - до
, у присутності сірчаної кислоти - до  .
.
Інструкція
Перш ніж приступати до завдання, потрібно засвоїти, що цифра, яка ставиться перед хімічним елементомабо всією формулою коефіцієнтом. А цифра, що стоїть (і трохи) індекс. Крім цього , що:
Коефіцієнт відноситься до всіх хімічних символів, що стоять після нього у формулі
Коефіцієнт множиться на індекс (не складається!)
Атомів кожного елемента речовин, що вступають у реакцію, має збігатися з числом атомів цих елементів, що входять до продуктів реакції.
Наприклад, запис формули 2H2SO4 означає 4 атоми H (водню), 2 атоми S (сірки) та 8 атомів O (кисню).
1. Приклад № 1. Розглянемо горіння етилену.
При згорянні органічної речовиниутворюються оксид вуглецю (IV) (вуглекислий газ) та вода. Спробуємо послідовно коефіцієнти.
C2H4 + O2 => CO2+ H2O
Починаємо аналізувати. У реакцію вступило 2 атоми С (вуглецю), а вийшов тільки 1 атом, значить перед CO2 ставимо 2. Тепер їх кількість однакова.
C2H4 + O2 => 2CO2+ H2O
Тепер дивимося на H (водень). У реакцію вступило 4 атоми водню, а вийшло в результаті лише 2 атоми, отже, перед H2O (водою) ставимо 2 – тепер вийшло теж 4
C2H4 + O2 => 2CO2+ 2H2O
Вважаємо всі атоми О (кисню), що утворилися в результаті реакції (тобто після рівності). 4 атоми в 2CO2 і 2 атоми в 2H2O - всього 6 атомів. А до реакції всього 2 атоми, отже, перед молекулою кисню O2 ставимо 3, отже, їх стало теж 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким чином, вийшла однакова кількість атомів кожного елемента до знаку рівності.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Приклад № 2. Розглянемо реакцію взаємодії алюмінію з розведеною сірчаною кислотою.
Al + H2SO4 => Al2 (SO4) 3 + H2
Дивимося на атоми S, що входять до складу Al2 (SO4) 3 - їх 3, а H2SO4 (сірчаної кислоти) тільки 1, отже, і перед сірчаною кислотою теж ставимо 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зате тепер вийшло до реакції 6 атомів H (водню), а після реакції лише 2, отже, перед молекулою H2 (водню) ставимо також 3, щоб у цілому вийшло 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В останню чергу дивимося на . Так як Al2 (SO4) 3 (сульфаті алюмінію) всього 2 атома алюмінію, то і до реакції перед Al (алюмінієм) ставимо 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Тепер кількість всіх атомів до реакції і після реакції збігається. Виявилося, що розставляти коефіцієнти у хімічних рівняннях не так і складно. Достатньо потренуватися і все вийде.
Обов'язково враховуйте, що коефіцієнт множиться на індекс, а чи не складається.
Джерела:
- як елементи вступають у реакцію
- Тест на тему «Хімічні рівняння»
Для багатьох школярів написати рівняння хімічних реакцій та правильно розставити коефіцієнтинелегке завдання. Причому головну трудність у них чомусь викликає саме друга її частина. Здавалося б, нічого складного в тому немає, проте часом учні пасують, впадаючи в повну розгубленість. Адже треба лише запам'ятати кілька простих правил, і завдання перестане викликати труднощі.
Інструкція
Коефіцієнт, тобто число, що стоїть перед формулою молекули хімічної речовини, до всіх символів, і множиться на кожен символ! Саме множиться, а не складається! Це може здатися неймовірним, але деякі школярі складають два числа замість того, щоб їх перемножити.
Кількість атомів кожного елемента вихідних речовин (тобто що у лівої частини рівняння) має збігатися з кількістю атомів кожного елемента продуктів реакції (відповідно, що у його правої частини).
Л  Чи можна розставляти коефіцієнти в хімічних рівняннях?
Чи можна розставляти коефіцієнти в хімічних рівняннях?
Ось мої діти та дорослі до хімії (я класний керівнику 8 «Б» класі). Хімію найчастіше хлопцям ставлять на першому уроці, а в четвер я не маю першого уроку, і я попросився на урок до Валентини Іванівни «на дітей подивитися» і перевірити щоденники. Тема мене захопила, у школі я любив хімію і щоденники я не перевірив. В черговий раз я переконався, що учні найчастіше відчувають труднощі через те, що не бачать міжпредметних зв'язків. На цьому уроці хімії учні мали скласти хімічні рівняння, знаючи валентність хімічних речовин. І багато учнів зазнали труднощів щодо числових коефіцієнтів. Наступний урок хімії у суботу ми з Валентиною Іванівною провели разом.
Вправа 1.
Запишіть у вигляді хімічних рівнянь такі речення:
А) «При випаленні карбонату кальцію утворюються оксид кальцію та оксид вуглецю (IV)»; б) «При взаємодії оксиду фосфору (V) з водою утворюється фосфорна кислота».
Рішення:
А) CaCO 3 = CaO + CO 2 – реакція ендотермічна. З цим завданням труднощів виявилося, оскільки потрібно було підшукувати числові коефіцієнти. Спочатку в лівій та правій частинах рівності по одному атому кальцію по одному атому вуглецю та по три атоми кисню.
Б) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - екзотермічна реакція. З другим рівняння виникли проблеми, без числових коефіцієнтів не вийшла вірна рівність: P 2 O 5 + H 2 O → H 3 PO 4 . Вочевидь , що з складання правильної рівності необхідно підбирати числові коефіцієнти. Якщо підбирати, то можна почати з фосфору: зліва два атоми, а праворуч – один, тому перед формулою азотної кислотипоставимо числовий множник, що дорівнює двом і тоді отримаємо: P 2 O 5 + H 2 O → 2H 3 PO 4 . Але тепер залишилося зрівняти число атомів кисню і водню: водню ліворуч два атоми , а праворуч - шість атомів, тому перед формулою води поставимо числовий коефіцієнт, що дорівнює трьом і тоді отримаємо: P 2 O 5 + 3H 2 O → 2H 3 PO 4 . Тепер легко переконатися, що в кожній частині рівняння рівні кількості і атомів фосфору і атомів водню і атомів кисню , отже, ми отримали правильне рівняння хімічної реакції: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
Другий спосіб: алгебраїчний.Припустимо, що в рівнянні поставили три коефіцієнти а, в, з , що вийшло вірне рівняння хімічної реакції: а P 2 O 5 + в H 2 O = з H 3 PO 4 . Оскільки в рівнянні використовуються атоми трьох видів, то складемо систему з трьох лінійних рівняньз трьома невідомими а, ві з .
Речовини, які використовувалися у хімічній реакції: Р – фосфор; Про 2 - кисень; P2O5 – оксид фосфору (V).
В) Fe 2 (SO 4) 3 + KOH → Fe(OH) 3 + K 2 SO 4 .
Речовини, які використовувалися у хімічній реакції: Fe 2 (SO 4) 3 – сульфат заліза (III); KOH – гідроксид калію; Fe(OH) 3 – гідроксид заліза (III); K 2 SO 4 - сульфат калію.
Г) CuOH → Cu 2 O + H 2 O.
Рішення: 2CuOH = Cu 2 O + H 2 O. Завдання визначення числових коефіцієнтів вирішували , складаючи систему рівнянь: 
Речовини, які використовувалися у хімічній реакції: CuOH – гідроксид міді (I); Cu 2 O – оксид міді (І); H 2 O – вода.
Д) CS 2 + O 2 → CO 2 + SO 2 .
Рішення: CS 2 + 3O 2 = CO 2 + 2SO 2 . Вирішували підбором коефіцієнтів: зрівняли число атомів сірки (2); зрівняли число атомів кисню (3).
Речовини, які використовувалися у хімічній реакції: CS 2 – сульфід сірки (IV); O 2 –
Речовини, які використовувалися у хімічній реакції: FeS 2 – колчедан; O 2 – кисень; Fe 2 O 3 – оксид заліза (III); SO 2 – оксид сірки (IV).
Вправа 3.
(Було запропоновано на вирішення як самостійна робота).
Умова:
Запишіть рівняння хімічних реакцій за такими схемами:
А) фосфорна кислота + гідроксид натрію → фосфат натрію + вода;
Б) оксид натрію + вода → гідроксид натрію;
В) оксид заліза (II) + алюміній оксид алюмінію + залізо;
Г) гідроксид міді (II) → оксид міді (II) + вода.
Відповідь:
А) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
Б) Na 2 O + H 2 O = 2NaOH;
В) 3FeO + 2Al = Al 2 O 3 + 3Fe;
Г) Cu(OH) 2 = CuO + H 2 O.
За 10 хвилин 85% учнів впоралися із завданням на «відмінно», що приємно здивувало Валентину Іванівну.
Щоб з'ясувати, як зрівняти хімічне рівняння, спершу слід дізнатися призначення цієї науки.
Визначення
Хімія вивчає речовини, їх властивості, а також перетворення. Якщо не спостерігається зміни забарвлення, випадання осаду, виділення газоподібної речовини, то не відбувається жодної хімічної взаємодії.
Наприклад, при обробці напилком залізного цвяха метал просто перетворюється на порошок. В цьому випадку жодної хімічної реакції не відбувається.
Прожарювання перманганату калію супроводжується утворенням оксиду марганцю (4), виділенням кисню, тобто спостерігається взаємодія. У цьому виникає цілком закономірне питання, як правильно зрівнювати хімічні рівняння. Розберемо всі аспекти, пов'язані з такою процедурою.

Специфіка хімічних перетворень
Будь-які явища, що супроводжуються зміною якісного та кількісного складу речовин, належать до хімічних перетворень. У молекулярному вигляді процес згоряння заліза атмосфері можна висловити з допомогою символів і символів.
Методика розміщення коефіцієнтів
Як зрівнювати коефіцієнти у хімічних рівняннях? У курсі хімії середньої школирозуміється спосіб електронного балансу. Розглянемо процес докладніше. Для початку вихідної реакції необхідно розставити ступеня окислення у кожного хімічного елемента.
Існують певні правила, якими їх можна визначити у кожного елемента. У простих речовинах ступеня окиснення дорівнюють нулю. У бінарних сполуках у першого елемента вона є позитивною, відповідає вищій валентності. В останнього цей параметр визначається шляхом віднімання номера групи з восьми та має знак «мінус». У формулах, що складаються з трьох елементів, є свої нюанси обчислення ступенів окислення.
Для першого та останнього елемента порядок аналогічний визначенню в бінарних з'єднаннях, а обчислення центрального елемента складається рівняння. Сума всіх показників повинна дорівнювати нулю, виходячи з цього, обчислюється показник для середнього елемента формули.
Продовжимо розмову у тому, як зрівнювати хімічні рівняння методом електронного балансу. Коли ступеня окислення будуть поставлені, можна визначати ті іони чи речовини, які під час хімічної взаємодії змінили їх значення.
Знаками «плюс» та «мінус» необхідно вказати кількість електронів, які були прийняті (віддані) у процесі хімічної взаємодії. Між одержаними цифрами знаходять найменше загальне кратне.
При розподілі його на прийняті та віддані електрони отримують коефіцієнти. Як зрівняти хімічне рівняння? Отримані у балансі цифри слід поставити перед відповідними формулами. Обов'язковою умовоює перевірка кількості кожного елемента у лівій та правій частині. Якщо коефіцієнти розставлені правильно, їх кількість має бути однаковою.

Закон збереження маси речовин
Розмірковуючи, як зрівняти хімічне рівняння, необхідно використовувати саме цей закон. Враховуючи, що маса тих речовин, які вступили до хімічну реакцію, дорівнює масі продуктів, що утворюються, стає можливим постановка коефіцієнтів перед формулами. Наприклад, як зрівняти хімічне рівняння, якщо вступають у взаємодію прості речовини кальцій та кисень, а після завершення процесу виходить оксид?
Щоб впоратися з поставленим завданням, необхідно враховувати, що кисень є двоатомною молекулою з неполярним ковалентним зв'язком, тому його формула записується в наступному вигляді - О2. У правій частині при складанні оксиду кальцію (СаО) враховують валентність кожного елемента.
Спочатку необхідно перевірити кількість кисню у кожній частині рівняння, оскільки вона відрізняється. За законом збереження маси речовин перед формулою препарату необхідно поставити коефіцієнт 2. Далі проводиться перевірка кальцію. Щоб він був зрівняний, перед вихідним речовиною ставимо коефіцієнт 2. У результаті отримуємо запис:
- 2Са+О2=2СаО.

Розбір реакції методом електронного балансу
Як урівнювати хімічні рівняння? Приклади ОВР допоможуть відповісти на це запитання. Припустимо, що необхідно методом електронного балансу розставити коефіцієнти у запропонованій схемі:
- CuO + Н2 = Cu + Н2О.
Для початку у кожного з елементів у вихідних речовинах і продуктах взаємодії розставимо значення ступенів окиснення. Отримаємо наступний вид рівняння:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показники змінилися у міді та водню. Саме на їх основі складатимемо електронний баланс:
- Cu(+2)+2е=Cu(0) 1 відновник, окиснення;
- Н2(0)-2е=2Н(+) 1 окислювач, відновлення.
Виходячи з коефіцієнтів, одержаних в електронному балансі, отримуємо наступний запис запропонованого хімічного рівняння:
- CuO + Н2 = Cu + Н2О.
Візьмемо ще один приклад, який передбачає постановку коефіцієнтів:
- Н2+О2=Н2О.
Для того, щоб зрівняти на основі закону збереження речовин цю схему, необхідно почати з кисню. Зважаючи на те, що вступала в реакцію двоатомна молекула, перед формулою продукту взаємодії необхідно поставити коефіцієнт 2.
- 2Н2 + О2 = 2Н2О.

Висновок
З електронного балансу можна розставляти коефіцієнти у будь-яких хімічних рівняннях. Випускникам дев'ятих та одинадцятих класів освітніх установ, що вибирають іспит з хімії, в одному із завдань підсумкових тестів пропонують подібні завдання.



