Как да подредите коефициентите в химичните уравнения? Химични уравнения. Урок по химия на тема подреждане на коефициентите в уравненията на химичните реакции "(8 клас)
В урок 13 "" от курса " Химия за манекени» помислете за какво са предназначени химичните уравнения; ще научим как да изравняваме химичните реакции чрез правилно поставяне на коефициентите. Този урок ще изисква от вас да знаете основите на химията от предишните уроци. Не забравяйте да прочетете за елементния анализ за подробен поглед върху емпиричните формули и химическия анализ.
В резултат на реакцията на изгаряне на метан CH 4 в кислород O 2 се образуват въглероден диоксид CO 2 и вода H 2 O. Тази реакция може да бъде описана химично уравнение:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Нека се опитаме да извлечем повече информация от химическото уравнение, отколкото просто индикация продукти и реактивиреакции. Химичното уравнение (1) НЕ е пълно и следователно не дава никаква информация за това колко O 2 молекули се изразходват за 1 CH 4 молекула и колко CO 2 и H2 O молекули се получават в резултат. Но ако напишем числови коефициенти пред съответните молекулни формули, които показват колко молекули от всеки вид участват в реакцията, тогава получаваме пълно химично уравнениереакции.
За да завършите съставянето на химическото уравнение (1), трябва да запомните едно просто правило: вляво и десни частиУравнението трябва да съдържа еднакъв брой атоми от всеки вид, тъй като в хода на химическата реакция не се създават нови атоми и съществуващите не се унищожават. Това правило се основава на закона за запазване на масата, който обсъдихме в началото на главата.
Това е необходимо, за да се получи пълно такова от просто химическо уравнение. И така, нека преминем към директното уравнение на реакцията (1): погледнете отново химичното уравнение, точно атомите и молекулите от дясната и лявата страна. Лесно е да се види, че в реакцията участват три типа атоми: въглерод С, водород Н и кислород О. Нека преброим и сравним броя на атомите от всеки тип от дясната и лявата страна на химичното уравнение.

Да започнем с въглерода. От лявата страна един C атом е част от молекулата CH 4, а от дясната страна един C атом е част от CO 2. Така броят на въглеродните атоми от лявата и от дясната страна е еднакъв, така че го оставяме на мира. Но за по-голяма яснота поставяме коефициент 1 пред молекули с въглерод, въпреки че това не е необходимо:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
След това пристъпваме към преброяване на водородните атоми H. От лявата страна има 4 H атома (в количествен смисъл H 4 = 4H) в състава на молекулата CH 4, а отдясно - само 2 H атома в състава на молекулата H 2 O, което е два пъти по-малко, отколкото в лявата страна на химическото уравнение (2). Да изравним! За да направим това, поставяме коефициент 2 пред молекулата H 2 O. Сега ще имаме 4 водородни молекули H както в реагентите, така и в продуктите:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Моля, обърнете внимание, че коефициентът 2, който написахме пред водната молекула H 2 O, за да изравним водорода H, удвоява всички атоми, които съставляват неговия състав, т.е. 2H 2 O означава 4H и 2O. Добре, това изглежда е решено, остава да се изчисли и сравни броят на кислородните атоми O в химическото уравнение (3). Веднага хваща окото, че в лявата страна на O атомите са точно 2 пъти по-малко, отколкото в дясната. Сега вече знаете как сами да изравнявате химичните уравнения, така че веднага ще запиша крайния резултат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O или CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Както можете да видите, подравняването химична реакцияне е толкова сложно нещо и тук не е важна химията, а математиката. Уравнение (4) се нарича пълно уравнениехимична реакция, тъй като при нея се спазва законът за запазване на масата, т.е. броят на атомите от всеки вид, влизащи в реакцията, е точно същият като броя на атомите от този вид в края на реакцията. Всяка част от това пълно химическо уравнение съдържа 1 въглероден атом, 4 водородни атома и 4 кислородни атома. Струва си обаче да се разберат няколко важни момента: химическата реакция е сложна последователност от отделни междинни етапи и следователно е невъзможно, например, да се тълкува уравнение (4) в смисъл, че 1 молекула метан трябва едновременно да се сблъска с 2 молекули кислород. Процесите, протичащи по време на образуването на реакционни продукти, са много по-сложни. Втора точка: пълно уравнениереакцията не ни казва нищо за нейния молекулярен механизъм, т.е. за последователността от събития, които се случват на молекулярно ниво по време на нейното протичане.
Коефициенти в уравненията на химичните реакции
Още един добър пример за правилното подреждане коефициентив уравненията на химичните реакции: Тринитротолуен (TNT) C 7 H 5 N 3 O 6 енергично се свързва с кислород, образувайки H 2 O, CO 2 и N 2. Пишем уравнението на реакцията, което ще изравним:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
По-лесно е да напишете пълното уравнение на базата на две молекули TNT, тъй като лявата страна съдържа нечетен брой водородни и азотни атоми, а дясната страна съдържа четен брой:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тогава е ясно, че 14 въглеродни атома, 10 водородни атома и 6 азотни атома трябва да се превърнат в 14 молекули въглероден диоксид, 5 водни молекули и 3 азотни молекули:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Сега и двете части съдържат еднакъв брой всички атоми с изключение на кислорода. От 33-те кислородни атома в дясната страна на уравнението, 12 се доставят от оригиналните две TNT молекули, а останалите 21 трябва да се доставят от 10,5 O 2 молекули. Така пълното химично уравнение ще изглежда така:
- 2C 7 H 5 N 3 O 6 + 10,5 O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можете да умножите двете страни по 2 и да се отървете от нецелия фактор 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Но това не може да се направи, тъй като не е задължително всички коефициенти на уравнението да са цели числа. Още по-правилно е да се направи уравнение на базата на една молекула TNT:
- C 7 H 5 N 3 O 6 + 5,25 O 2 → 7CO 2 + 2,5 H 2 O + 1,5 N 2 (10)
Пълното химическо уравнение (9) носи много информация. На първо място, той показва изходните вещества - реактиви, както и продуктиреакции. В допълнение, това показва, че в хода на реакцията всички атоми от всеки вид се запазват индивидуално. Ако умножим двете страни на уравнение (9) по числото на Авогадро N A =6,022 10 23, можем да заявим, че 4 мола TNT реагират с 21 мола O 2, за да образуват 28 мола CO 2, 10 мола H 2 O и 6 мола N2.
Има още една особеност. Използвайки периодичната таблица, ние определяме молекулните тегла на всички тези вещества:
- C 7 H 5 N 3 O 6 \u003d 227,13 g / mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Уравнение 9 сега също ще показва, че 4 x 227,13 g = 908,52 g TNT са необходими за изпълнение пълна реакция 21 31,999 g = 671,98 g кислород и в резултат на това се образуват 28 44,010 g = 1232,3 g CO 2, 10 18,015 g = 180,15 g H 2 O и 6 28,013 g = 168,08 g N 2 . Нека проверим дали законът за запазване на масата е изпълнен в тази реакция:
| Реактиви | Продукти | |
| 908,52 g тротил | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168.08 g N2 | ||
| Обща сума | 1580,5 g | 1580,5 g |
Но не е необходимо отделните молекули да участват в химическа реакция. Например, реакцията на варовик CaCO3 и на солна киселина HCl, с образуването на воден разтвор на калциев хлорид CaCl2 и въглероден диоксид CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Химично уравнение (11) описва реакцията на калциев карбонат CaCO 3 (варовик) и солна киселина HCl за образуване на воден разтвор на калциев хлорид CaCl 2 и въглероден диоксид CO 2 . Това уравнение е пълно, тъй като броят на атомите от всеки вид в лявата и дясната му страна е еднакъв.
Значението на това уравнение е макроскопично (моларно) нивое както следва: 1 mol или 100,09 g CaCO 3 изисква 2 mol или 72,92 g HCl, за да завърши реакцията, което води до 1 mol CaCl 2 (110,99 g / mol), CO 2 (44,01 g / mol) и H 2 О (18,02 g/mol). От тези цифрови данни е лесно да се провери, че законът за запазване на масата е изпълнен в тази реакция.
Тълкуване на уравнение (11) на микроскопично (молекулярно) нивоне е толкова очевидно, тъй като калциевият карбонат е сол, а не молекулно съединение и следователно е невъзможно да се разбере химическото уравнение (11) в смисъл, че 1 молекула калциев карбонат CaCO 3 реагира с 2 молекули HCl. Освен това молекулата на HCl в разтвор обикновено се дисоциира (разлага) на H + и Cl - йони. Така че повече правилно описаниетова, което се случва в тази реакция на молекулярно ниво, дава уравнението:
- CaCO 3 (твърд) + 2H + (воден) → Ca 2+ (воден) + CO 2 (g.) + H 2 O (l.) (12)
Тук, в скоби, физическото състояние на всеки вид частици е съкратено ( телевизия.- твърд, aq.е хидратиран йон във воден разтвор, Ж.- газ, и.- течност).
Уравнение (12) показва, че твърдият CaCO 3 реагира с два хидратирани H + йона, образувайки положителен Ca 2+ йон, CO 2 и H 2 O. Уравнение (12), подобно на други пълни химични уравнения, не дава представа за молекулярният механизъм реагира и е по-малко удобен за преброяване на количеството вещества, но дава най-доброто описаниекоето се случва на микроскопично ниво.
Затвърдете знанията си за формулирането на химични уравнения, като самостоятелно анализирате примера с решението:
Надявам се от урок 13 " Съставяне на химични уравнения» научихте нещо ново за себе си. Ако имате въпроси, напишете ги в коментарите.
Инструкция
Преди да преминете към самата задача, трябва да научите, че числото, което се поставя пред химичен елемент или цялата формула, е коефициент. И фигурата стои (и леко) индекс. Освен това, че:
Коефициентът се прилага за всички химически символи, следващи го във формулата
Коефициентът се умножава по индекса (не се събира!)
Атомите на всеки елемент от реагиращите вещества трябва да съответстват на броя на атомите на тези елементи, включени в продуктите на реакцията.
Например формулата 2H2SO4 означава 4 H (водород), 2 S (сяра) и 8 O (кислород) атоми.
1. Пример № 1. Разгледайте изгарянето на етилен.
При изгаряне органична материяобразуват се въглероден оксид (IV) (въглероден диоксид) и вода. Нека опитаме коефициентите един по един.
C2H4 + O2 => CO2 + H2O
Започваме да анализираме. В реакцията са влезли 2 атома C (въглерод) и се е получил само 1 атом, което означава, че пред CO2 поставяме 2. Сега броят им е същият.
C2H4 + O2 => 2CO2+ H2O
Сега вижте H (водород). 4 водородни атома влязоха в реакцията и в резултат се получиха само 2 атома, следователно поставихме 2 пред H2O (вода) - сега също получаваме 4
C2H4 + O2 => 2CO2+ 2H2O
Разглеждаме всички атоми О (кислород), образувани в резултат на реакцията (т.е. след равенство). 4 атома в 2CO2 и 2 атома в 2H2O - общо 6 атома. А преди реакцията има само 2 атома, което означава, че поставяме 3 пред кислородната молекула O2, което означава, че има и 6 от тях.
C2H4 + 3O2 => 2CO2+ 2H2O
Така се оказа еднакъв брой атоми на всеки елемент преди и след знака за равенство.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Разгледайте реакцията на взаимодействието на алуминий с разредена сярна киселина.
Al + H2SO4 => Al2 (SO4) 3 + H2
Разглеждаме S атомите, които изграждат Al2 (SO4) 3 - има 3 от тях, а в H2SO4 (сярна киселина) само 1, следователно поставяме и 3 пред сярна киселина.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Но сега се оказа, че преди реакцията има 6 атома Н (водород), а след реакцията само 2, което означава, че поставяме и 3 пред молекулата Н2 (водород), така че общо получаваме 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
И накрая, погледнете. Тъй като има само 2 алуминиеви атома в Al2 (SO4) 3 (алуминиев сулфат), поставяме 2 преди реакцията преди Al (алуминий).
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Сега броят на всички атоми преди и след реакцията е еднакъв. Оказа се, че за подреждане на коефициентите в химични уравненияне е толкова трудно. Просто достатъчно практика и ще се оправите.
Не забравяйте да имате предвид, че коефициентът се умножава по индекса, а не се добавя.
източници:
- как реагират елементите
- Тест по темата "Химични уравнения"
За много ученици напишете уравненията на химичните реакции и ги подредете правилно коефициентине е лесна задача. Освен това, по някаква причина, втората част от него причинява основната трудност за тях. Изглежда, че в това няма нищо трудно, но понякога учениците се поддават, изпадайки в пълно объркване. Но просто трябва да запомните няколко прости правилаи задачата вече няма да създава трудности.
Инструкция
Коефициентът, тоест числото пред формулата на молекулата химически, към всички знаци и умножено по всеки от всеки знак! Умножава се, не се събира! Може да изглежда невероятно, но някои ученици добавят две числа, вместо да ги умножат.
Броят на атомите на всеки елемент от изходните вещества (т.е. тези от лявата страна на уравнението) трябва да съвпада с броя на атомите на всеки елемент от реакционните продукти (съответно тези от дясната му страна).
Уравнението на реакцията в химията е запис на химичен процес с помощта на химични формули и математически знаци.
Такъв запис е схема на химическа реакция. Когато се появи знакът „=“, това се нарича „уравнение“. Нека се опитаме да го разрешим.
Пример за разбор на прости реакции
Калцият има един атом, тъй като коефициентът не си струва. Индексът също не е написан тук, което означава, че е единица. От дясната страна на уравнението Ca също е едно. Не е нужно да работим върху калций.
Разглеждаме следващия елемент – кислорода. Индекс 2 показва, че има 2 кислородни йона. От дясната страна няма индекси, тоест една частица кислород, а отляво - 2 частици. Какво правим? Не могат да се правят допълнителни индекси или корекции на химичната формула, тъй като е написана правилно.
Коефициентите са това, което е написано преди най-малката част. Те имат право на промяна. За удобство не пренаписваме самата формула. От дясната страна умножаваме едно по 2, за да получим и там 2 кислородни йона.

След като зададохме коефициента, получихме 2 калциеви атома. Има само един от лявата страна. Така че сега трябва да поставим 2 пред калций.

Сега нека проверим резултата. Ако броят на атомите на елемента е равен от двете страни, тогава можем да поставим знак "равно".

Друг добър пример: два водорода отляво и след стрелката също имаме два водорода.

- Два оксигена преди стрелката, а след стрелката няма индекси, което означава едно.
- Повече отляво, по-малко отдясно.
- Поставяме коефициент 2 пред водата.

Умножихме цялата формула по 2 и сега променихме количеството водород. Умножаваме индекса по коефициента и се оказва 4. А от лявата страна има два водородни атома. И за да получим 4, трябва да умножим водорода по две.

Ето случая, когато елементът в едната и другата формула е от една страна, до стрелката.

Един серен йон отляво и един серен йон отдясно. Две частици кислород плюс още две частици кислород. Има 4 кислорода от лявата страна. Вдясно има 3 кислорода. Тоест от една страна се получава четен брой атоми, а от друга - нечетен брой. Ако умножим нечетно число по 2, получаваме четно число. Първо го довеждаме до равна стойност. За да направите това, умножете по две цялата формула след стрелката. След умножение получаваме шест кислородни йона и дори 2 серни атома. Отляво имаме една микрочастица сяра. Сега нека го изравним. Поставяме уравнения отляво пред сиво 2.

Наречен.
Сложни реакции
Този пример е по-сложен, тъй като има повече елементи на материята.

Това се нарича реакция на неутрализация. Какво трябва да се изравни тук първо:
- От лявата страна има един натриев атом.
- От дясната страна индексът казва, че има 2 натрия.
Изводът предполага, че е необходимо цялата формула да се умножи по две.

Сега да видим колко сяра. По един от лявата и дясната страна. Обърнете внимание на кислорода. От лявата страна имаме 6 кислородни атома. От друга страна - 5. По-малко отдясно, повече отляво. нечетно числотрябва да се доведе до равномерна стойност. За да направим това, умножаваме водната формула по 2, тоест правим 2 от един кислороден атом.
Сега от дясната страна вече има 6 кислородни атома. От лявата страна също има 6 атома. Проверка на водорода. Два водородни атома и още 2 водородни атома. Тоест ще има четири водородни атома от лявата страна. И от другата страна също четири водородни атома. Всички елементи са балансирани. Поставяме знак "равно".

Следващ пример.

Тук примерът е интересен с това, че се появиха скоби. Казват, че ако факторът е извън скобите, тогава всеки елемент в скобите се умножава по него. Трябва да започнете с азот, тъй като е по-малко от кислорода и водорода. Отляво има един азот, а отдясно, като се вземат предвид скобите, има два.

Има два водородни атома отдясно, но са необходими четири. Излизаме от ситуацията, като просто умножим водата по две, което води до четири водорода. Страхотно, водородът изравни. Има останал кислород. Преди реакцията има 8 атома, след нея също 8.
Чудесно, всички елементи са равни, можем да поставим "равни".

Последен пример.

Следващият е барият. Нивелиран е, не е необходимо да се пипа. Преди реакцията има два хлора, след нея - само един. Какво трябва да се направи? Поставете 2 пред хлор след реакцията.

Сега, поради коефициента, който току-що беше зададен, след реакцията бяха получени два натрия, а преди реакцията също два. Супер, всичко останало е балансирано.

Реакциите могат да бъдат изравнени и с помощта на метода на електронния баланс. Този метод има редица правила, по които може да се приложи. Следващата стъпка е да се подредят степени на окисление на всички елементи във всяко вещество, за да се разбере къде е настъпило окислението и къде е извършено редуцирането.
Има няколко метода за определяне на коефициентите в уравненията на редокс реакциите. Използваме метода на електронния баланс, при който съставянето на пълното уравнение на OVR се извършва в следната последователност:
1. Направете схема на реакция, като посочите веществата, които са реагирали, и веществата, получени в резултат на реакцията, например:
2. Определете степента на окисление на атомите и напишете нейния знак и стойност над символите на елементите, като маркирате елементите, чиято степен на окисление се е променила:
3. Запишете електронните уравнения на реакциите на окисление и редукция, определете броя на електроните, отдадени от редуктора и приети от окислителя, и след това ги изравнете, като ги умножите по съответните коефициенти:
4. Получените коефициенти, съответстващи на електронния баланс, се прехвърлят към основното уравнение:
5. Изравнете броя на атомите и йоните, които не променят степента на окисление (в последователността: метали, неметали, водород):
6. Проверете правилността на избора на коефициенти по броя на кислородните атоми в лявата и дясната част на уравнението на реакцията - те трябва да са равни (в това уравнение 24 = 18 + 2 + 4, 24 = 24).
Нека да разгледаме по-сложен пример:
Нека да определим степени на окисление на атомите в молекулите:
Съставяме електронните уравнения за реакциите на окисление и редукция и изравняваме броя на отдадените и получените електрони:
Нека прехвърлим коефициентите към основното уравнение:
Изравнете броя на атомите, които не променят степента на окисление:
Като преброим броя на кислородните атоми от дясната и лявата страна на уравнението, ние се уверяваме, че коефициентите са избрани правилно.
Най-важните окислители и редуктори
Редокс свойствата на елементите зависят от структурата на електронната обвивка на атомите и се определят от тяхното положение в периодичната система на Менделеев.
Металите, които имат 1-3 електрона на външно енергийно ниво, лесно ги отдават и проявяват само редуциращи свойства. Неметалите (елементи от групи IV-VII) могат както да отдават, така и да приемат електрони, така че могат да проявяват както редуциращи, така и окислителни свойства. В периоди с увеличаване на поредния номер на елемента редукционните свойства на простите вещества отслабват, а окислителните се увеличават. В групи с увеличаване на серийния номер, редукционните свойства се засилват, а окислителните свойства се отслабват. По този начин, от простите вещества най-добрите редуциращи агенти са алкални метали, алуминий, водород, въглерод; най-добрите окислители са халогените и кислорода.
Редокс свойствата на сложните вещества зависят от степента на окисление на атомите, които съставляват техния състав. Веществата, съдържащи атоми с най-ниска степен на окисление, проявяват редуциращи свойства. Най-важните редуциращи агенти са въглеродният окис.  , водороден сулфид
, водороден сулфид  , железен (II) сулфат
, железен (II) сулфат  .Веществата, които съдържат атоми с най-висока степен на окисление, проявяват окислителни свойства. Най-важните окислители са калиевият перманганат
.Веществата, които съдържат атоми с най-висока степен на окисление, проявяват окислителни свойства. Най-важните окислители са калиевият перманганат  , калиев дихромат
, калиев дихромат  , водороден прекис
, водороден прекис  ,
Азотна киселина
,
Азотна киселина , концентрирана сярна киселина
, концентрирана сярна киселина  .
.
Веществата, съдържащи атоми с междинно състояние на окисление, могат да се държат като окислители или редуциращи агенти.в зависимост от свойствата на веществата, с които взаимодействат, и условията на реакцията. Така че в реакция с  Сярната киселина проявява редуциращи свойства:
Сярната киселина проявява редуциращи свойства:
и когато взаимодейства със сероводород, той е окислител:

В допълнение, за такива вещества са възможни реакции на самоокисление-самовъзстановяване, протичащи с едновременно увеличаване и намаляване на степента на окисление на атомите на един и същ елемент, например:
Силата на много окислители и редуциращи агенти зависи от pH на средата. Например, 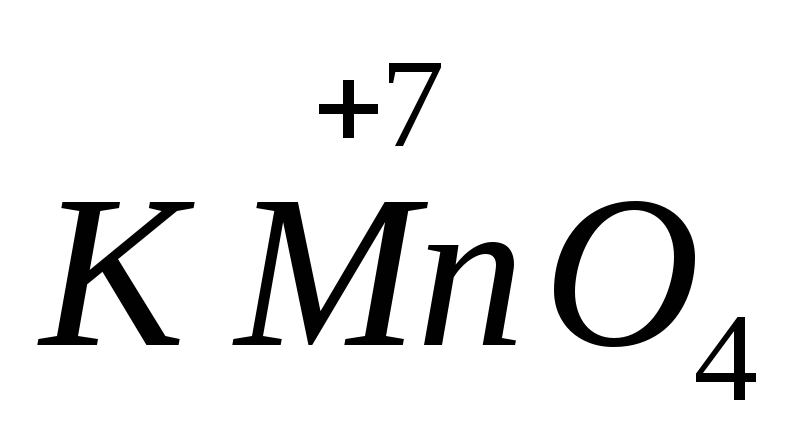 в алкална среда се редуцира до
в алкална среда се редуцира до  , в неутрално към
, в неутрално към  , при наличие на сярна киселина - до
, при наличие на сярна киселина - до  .
.
Днес ще говорим за това как да подредим коефициентите в химичните уравнения. Този въпрос е от интерес не само за ученици от гимназията на образователни институции, но и за деца, които тепърва се запознават с основните елементи на комплекс и интересна наука. Ако разберете на първия етап, в бъдеще няма да има проблеми с решаването на проблеми. Нека го направим от самото начало.
Какво е уравнение
Под него е обичайно да се разбира условен запис на химическа реакция, протичаща между избраните реагенти. За такъв процес се използват индекси, коефициенти, формули.
Алгоритъм за компилация
Как се пишат химични уравнения? Примери за всякакви взаимодействия могат да бъдат написани чрез сумиране на оригиналните съединения. Знакът за равенство показва, че има взаимодействие между реагиращите вещества. След това се съставя формула за продукти по валентност (степен на окисление).
Как да запишете реакция
Например, ако трябва да напишете химични уравнения, които потвърждават свойствата на метана, изберете следните опции:
- халогениране (радикално взаимодействие с елемент VIIA от периодичната таблица на Д. И. Менделеев);
- изгаряне в атмосферен кислород.
За първия случай от лявата страна записваме изходните вещества, а от дясната - получените продукти. След като проверим броя на атомите на всеки химичен елемент, получаваме окончателния запис на протичащия процес. При изгаряне на метан в атмосферен кислород възниква екзотермичен процес, в резултат на който се образуват въглероден диоксид и водни пари.
За правилното поставяне на коефициентите в химичните уравнения се използва законът за запазване на масата на веществата. Започваме процеса на коригиране, като определяме броя на въглеродните атоми. След това извършваме изчисления за водород и едва след това проверяваме количеството кислород.
OVR
Сложните химични уравнения могат да бъдат изравнени с помощта на метода на електронния баланс или полуреакциите. Предлагаме последователност от действия, предназначени да подредят коефициентите в реакциите от следните типове:
- разграждане;
- заместване.

Първо, важно е да се подреди степента на окисление на всеки елемент в съединението. При поставянето им е необходимо да се вземат предвид някои правила:
- При просто веществото е равно на нула.
- В двоично съединение тяхната сума е 0.
- В съединение от три или повече елемента, първият показва положителна стойност, екстремният йон - отрицателно значениестепен на окисление. Централният елемент се изчислява математически, като се има предвид, че сумата трябва да бъде 0.
След това се избират онези атоми или йони, чието състояние на окисление се е променило. Знаците плюс и минус показват броя на електроните (приети, отдадени). След това се определя най-малкото кратно между тях. При разделянето на НОК на тези числа се получават числата. Този алгоритъм ще бъде отговорът на въпроса как да подредите коефициентите в химичните уравнения.
Първи пример
Да кажем, че е дадена задачата: "Подредете коефициентите в реакцията, попълнете празнините, определете окислителя и редуциращия агент." Такива примери се предлагат на абитуриенти, които са избрали за изпит химия.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Нека се опитаме да разберем как да подредим коефициентите в химичните уравнения, предлагани на бъдещите инженери и лекари. След като подредим степени на окисление на елементите в изходните материали и наличните продукти, откриваме, че мангановият йон действа като окислител, а бромидният йон демонстрира редуциращи свойства.
Заключаваме, че липсващите вещества не участват в редокс процеса. Един от липсващите продукти е вода, а вторият ще бъде калиев сулфат. След съставянето на електронния баланс последната стъпка ще бъде задаване на коефициентите в уравнението.
Втори пример
Нека дадем друг пример, за да разберем как да подредим коефициентите в химическите уравнения от редокс тип.
Да кажем, че имаме следната схема:
P + HNO 3 \u003d NO 2 + ... + ...
Фосфорът, който по дефиниция е просто вещество, проявява редуциращи свойства, повишавайки степента на окисление до +5. Следователно едно от липсващите вещества ще бъде фосфорната киселина H 3 PO 4. OVR предполага наличието на редуциращ агент, който ще бъде азот. Той преминава в азотен оксид (4), образувайки NO 2

За да поставим коефициентите в тази реакция, ще направим електронен баланс.
P 0 връща 5e = P +5
N +5 взема e = N +4
Като се има предвид, че азотната киселина и азотният оксид (4) трябва да бъдат предшествани от коефициент 5, получаваме крайната реакция:
P + 5HNO 3 \u003d 5NO 2 + H 2 O + H 3 PO 4
Стереохимичните коефициенти в химията позволяват решаването на различни изчислителни задачи.
Трети пример
Като се има предвид, че поставянето на коефициенти създава трудности за много ученици в гимназията, е необходимо да се изработи последователността от действия, като се използват конкретни примери. Предлагаме още един пример за задача, чието изпълнение изисква владеене на метода за подреждане на коефициентите в окислително-възстановителната реакция.
H 2 S + HMnO 4 \u003d S + MnO 2 +…

Особеността на предложената задача е, че е необходимо да се допълни липсващият реакционен продукт и едва след това можете да пристъпите към задаване на коефициентите.
След като подредим степени на окисление на всеки елемент в съединенията, можем да заключим, че окислителни свойствапоказва манган, който понижава валентността. Сярата демонстрира редуцираща способност в предложената реакция, като се редуцира до просто вещество. След съставянето на електронния баланс ще трябва само да поставим коефициентите в предложената схема на процеса. И делото е свършено.
Четвърти пример
Химичното уравнение се нарича пълен процес, когато съдържа изцялосе спазва законът за запазване на масата. Как да проверите този модел? Броят на атомите от същия тип, които са влезли в реакцията, трябва да съответства на техния брой в продуктите на взаимодействието. Само в този случай ще бъде възможно да се говори за полезността на записаното химично взаимодействие, възможността за прилагането му за изчисления, решаване на изчислителни проблеми различни ниватрудности. Ето един вариант на задачата, който включва подреждането на липсващите стереохимични коефициенти в реакцията:
Si + ... + HF = H 2 SiF 6 + NO + ...

Сложността на задачата е, че се пропускат както изходните вещества, така и продуктите на взаимодействието. След като зададем всички елементи на степента на окисление, виждаме, че силициевият атом проявява редуциращи свойства в предложената задача. Сред продуктите на реакцията присъства азот (II), едно от изходните съединения е азотната киселина. Логично определяме, че липсващият продукт от реакцията е водата. Последната стъпка ще бъде подреждането на получените стереохимични коефициенти в реакцията.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Пример за задача с уравнение
Необходимо е да се определи обемът на 10% разтвор на хлороводород, чиято плътност е 1,05 g / ml, необходима за пълното неутрализиране на калциевия хидроксид, образуван по време на хидролизата на неговия карбид. Известно е, че отделеният при хидролизата газ заема обем от 8,96 литра (n.a.).
CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
Калциевият хидроксид взаимодейства с хлороводорода, настъпва пълна неутрализация:
Ca (OH) 2 + 2HCl \u003d CaCl 2 + 2H 2 O

Изчисляваме масата на киселината, необходима за този процес. Определете обема на разтвора на хлороводород. Всички изчисления за задачата се извършват, като се вземат предвид стереохимичните коефициенти, което потвърждава тяхната важност.
Накрая
Анализ на резултатите от единичен държавен изпитпо химия показва, че задачите, свързани със задаване на стереохимични коефициенти в уравнения, съставяне на електронен баланс, определяне на окислител и редуктор създават сериозни затруднения на съвременните висшисти общообразователни училища. За съжаление, степента на независимост на съвременните възпитаници е практически минимална, така че учениците от гимназията не разработват теоретичната база, предложена от учителя.
Между често срещани грешки, което учениците позволяват чрез поставяне на коефициентите в реакциите различен тип, много математически грешки. Например, не всеки знае как да намери най-малкото общо кратно, да разделя и умножава числата правилно. Причината за това явление е намаляването на броя на часовете, посветени на образователни училищаза изучаване на тази тема. При основна програмапо химия учителите нямат възможност да разработят с учениците си въпроси, свързани със съставянето на електронен баланс в редокс процеса.



