Алкени хімічні властивості таблиці. Алкени - Гіпермаркет знань
Для алкенів характерні насамперед реакції приєднанняз подвійного зв'язку. В основному ці реакції йдуть за іонним механізмом. Пі-зв'язок розривається, і утворюються дві нові сигма-зв'язки. Нагадаю, що для алканів типовими були реакції заміщення та йшли вони за радикальним механізмом. Приєднуватися до алкенів можуть молекули водню, ці реакції називають гідрування, молекули води, гідратація, галогени - галогенування, галогенводні - гідрогалогенування. Але про все по порядку.
Реакції приєднання з подвійного зв'язку
Отже, першехімічна властивість - здатність приєднувати галогеноводи, гідрогалогенування.
Пропен та інші алкени реагують з галогеноводородами за правилом Марковникова.

Атом водню приєднується до найбільш гідрованого, або правильніше сказати гідрогенізованого атома вуглецю.
Другимномером у нашому списку властивостей буде гідратація, приєднання води.
Реакція відбувається при нагріванні в присутності кислоти — зазвичай сірчаної або фосфорної. Приєднання води відбувається також за правилом Марковникова, тобто первинний спирт можна отримати лише гідратацією етилену, решта нерозгалужених алкенів дає вторинні спирти.
І для гідрогалогеніювання та для гідратації існують винятки з правила Марковникова. По-перше, проти цього правила приєднання протікає у присутності пероксидів.
По-друге, для похідних алкенів, у яких є електронноакцепторні групи. Наприклад, для 3,3,3-трифторпропену-1.

Атоми фтору за рахунок високої електронегативності відтягують на себе електронну щільність ланцюга сигма-зв'язків. Таке явище називається негативним індуктивним ефектом.

Через це відбувається зміщення рухомих пі-електронів подвійного зв'язку і крайнього атома вуглецю виявляється частковий позитивний заряд, який зазвичай позначається як дельта плюс. Саме до нього і піде негативно заряджений іон брому, а катіон водню приєднається до найменш гідрованого атома вуглецю.
Крім трифторметильної групи негативний індуктивний ефект має, наприклад, трихлорметильна група, нітрогрупа, карбоксильна група та деякі інші.
Цей другий випадок порушення правила Марковникова в ЄДІ зустрічається дуже рідко, але бажано мати його на увазі, якщо ви плануєте скласти іспит на максимальний бал.
Третєхімічна властивість – приєднання молекул галогенів.

Насамперед це стосується брому, оскільки дана реакція є якісною на кратний зв'язок. При пропущенні, наприклад, етилену через бромну воду, тобто розчин брому у воді, що має коричневий колір, відбувається її знебарвлення. Якщо пропускати через бромну воду суміш газів, наприклад, етан і етен, то можна отримати чистий етан без домішки етену, оскільки той залишиться в реакційній колбі у вигляді диброметана, що є рідиною.
Особливо варто відзначити реакцію алкенів у газовій фазі при сильному нагріванні, наприклад, з хлором.
За таких умов протікає реакція приєднання, а реакція заміщення. При чому виключно по альфа-атому вуглецю, тобто атому, що сусідить з подвійним зв'язком. В даному випадку виходить 3-хлорпропен-1. Ці реакції на іспиті зустрічаються нечасто, тому більшість учнів їх не пам'ятає і, як правило, робить помилки.
Четвертимномером йде реакція гідрування, а разом із нею і реакція дегідрування. Тобто приєднання чи відщеплення водню.

Гідрування відбувається за не дуже високої температури на нікелевому каталізаторі. При вищій температурі можливе дегідрування з одержанням алкінів.
П'ятимвластивістю алкенів є здатність до полімеризації, коли сотні та тисячі молекул алкену за рахунок розриву пі-зв'язку та утворення сигма-зв'язків один з одним утворюють дуже довгі та міцні ланцюжки.
У цьому випадку вийшов поліетилен. Зверніть увагу, що в молекулі, що вийшла, кратні зв'язки відсутні. Такі речовини називаються полімерами, вихідні молекули називаються мономерами, фрагмент, що повторюється - це елементарна ланка полімеру, а число n - ступінь полімеризації.
Також можливі реакції отримання інших важливих полімерних матеріалів, наприклад поліпропілену.


Ще один важливий полімер – полівінілхлорид.

Вихідною речовиною для виробництва цього полімеру є хлоретен, тривіальна назва якого вінілхлорид. Оскільки цей ненасичений заступник називається вініл. Часто зустрічається абревіатура на пластмасових виробах ПВХ розшифровується як полівінілхлорид.
Ми обговорили п'ять властивостей, які були реакції приєднання по подвійному зв'язку. Тепер звернемося до реакцій окислення.
Реакції окислення алкенів
Шостехімічна властивість у нашому загальному списку – це м'яке окиснення або реакція Вагнера. Воно протікає при дії на алкен водяним розчином перманганату калію на холоду, тому часто в екзаменаційних завданнях вказують температуру нуль градусів.
В результаті виходить двоатомний спирт. В даному випадку етиленгліколь, а загалом такі спирти носять загальну назву гліколі. У процесі реакції фіолетово-рожевий розчин перманганату знебарвлюється, тому ця реакція є якісною на подвійний зв'язок. Марганець у нейтральному середовищі зі ступеня окиснення +7 відновлюється до ступеня окиснення +4. Розглянемо ще кілька прикладів. РІВНЯННЯ
Тут вийшов пропандіол-1,2. Проте так само реагуватимуть і циклічні алкени. РІВНЯННЯ
Ще один варіант, коли подвійний зв'язок знаходиться, наприклад, в бічній ланцюзі ароматичних вуглеводнів. Регулярно у завданнях егетрапляється реакція Вагнера за участю стиролу, його друга назва вінілбензол.

Я сподіваюся, що до вашої уваги достатньо прикладів, щоб ви зрозуміли, що м'яке окислення подвійного зв'язку завжди підпорядковується досить простому правилу- пі-зв'язок розривається і до кожного атома вуглецю приєднується гідроксигрупа.
Тепер щодо жорсткого окислення. Це буде наше сьомевластивість. Таке окислення відбувається, коли алкен реагує із кислотним розчином перманганату калію при нагріванні.
Відбувається деструкція молекули, тобто її руйнування подвійного зв'язку. У разі бутена-2 вийшли дві молекули оцтової кислоти. У цілому ж, за продуктами окиснення можна судити про становище кратного зв'язку у вуглецевому ланцюзі.
При окисленні бутену-1 виходить молекула пропіонової (пропанової) кислоти та вуглекислий газ.
У разі етилену вийде дві молекули вуглекислого газу. У всіх випадках у кислому середовищі марганець зі ступеня окиснення +7 відновлюється до +2.
І наостанок, восьмевластивість - повне окислення чи горіння.
Алкени згоряють, як і інші вуглеводні, до вуглекислого газу та води. Запишемо рівняння згоряння алкенів у загальному вигляді.
Молекул вуглекислого газу буде стільки ж, скільки атомів вуглецю в молекулі алкену, оскільки до складу молекули CO 2 входить один атом вуглецю. Тобто n молекул CO2. Молекул води буде вдвічі менше, ніж атомів водню, тобто 2n/2, отже просто n.
Атомів кисню ліворуч і праворуч однакова кількість. Праворуч їх 2n із вуглекислого газу плюс n із води, разом 3n. Зліва атомів кисню стільки ж, отже молекул вдвічі менше, оскільки у складі молекули входять два атома. Тобто 3n/2 молекул кисню. Можна записати 1,5 n.
Ми роздивились вісімхімічні властивості алкенів.
НЕПОМЕЖНІ, АБО НЕНАСИЩЕНІ, ВУГЛЕВОДОРОДИ РЯДУ ЕТИЛЕНУ (АЛКЕНИ, АБО ОЛЕФІНИ)
Алкени, або олефіни(від лат. olefiant - олія - стара назва, але широко використовується в хімічній літературі. Приводом до такої назви послужив хлористий етилен, отриманий у XVIII столітті, - рідка масляниста речовина. аліфатичні ненасичені вуглеводні, в молекулах яких між вуглецевими атомами є один подвійний зв'язок.
Алкени утворюють гомологічний ряд із загальною формулою CnH2n
1. Гомологічний ряд алкенів
Гомологи:
ЗH2 = CH2 Етен
ЗH2 = CH- CH3 пропен
ЗH2=CH-CH2-CH3бутен-1
ЗH2=CH-CH2-CH2-СН3 пентен-1
Етилен (етен) - безбарвний газ з дуже слабким солодкуватим запахом, трохи легший за повітря, малорозчинний у воді.
С2 – С4 (гази)
С5 - С17 (рідини)
С18 - (тверді)
· Алкени не розчиняються у воді, розчинні в органічних розчинниках (бензин, бензол та ін.)
· Легше води
· Зі збільшенням Mr температури плавлення та кипіння збільшуються
3. Найпростішим алкеном є етилен - C2H4
Структурна та електронна формули етилену мають вигляд:
У молекулі етилену піддаються гібридизації одна s- і дві p-орбіталі атомів C ( sp 2-гібридизація).

Таким чином, кожен атом C має по три гібридних орбіталі і по одній негібридній p-орбіталі. Дві з гібридних орбіталей атомів C взаємно перекриваються та утворюють між атомами C
σ – зв'язок. Інші чотири гібридних орбіталі атомів C перекриваються в тій же площині з чотирма. s-орбіталями атомів H і також утворюють чотири σ - зв'язок. Дві негібридні p-орбіталі атомів C взаємно перекриваються в площині, яка розташована перпендикулярно площині - зв'язок, тобто. утворюється одна П- Зв'язок.


За своєю природою П- Зв'язок різко відрізняється від σ - Зв'язок; П- зв'язок менш міцна внаслідок перекриття електронних хмар поза площиною молекули. Під дією реагентів П- Зв'язок легко розривається.
Молекула етилену симетрична; ядра всіх атомів розташовані в одній площині та валентні кути близькі до 120 °; відстань між центрами атомів C дорівнює 0,134 нм.
Якщо атоми з'єднані подвійним зв'язком, то їх обертання неможливе без того, щоб електронні хмари П- Зв'язок не розімкнулися.
4. Ізомерія алкенів
Поряд зі структурною ізомерією вуглецевого скелета для алкенів характерні, по-перше, інші різновиди структурної ізомерії. ізомерія положення кратного зв'язкуі міжкласова ізомерія.
По-друге, у ряді алкенів проявляється просторова ізомерія , пов'язана з різним становищем заступників щодо подвійного зв'язку, навколо якого неможливе внутрішньомолекулярне обертання
Структурна ізомерія алкенів
1. Ізомерія вуглецевого скелета (починаючи з С4Н8):
2. Ізомерія положення подвійного зв'язку (починаючи з С4Н8):
3. Міжкласова ізомерія з циклоалканами, починаючи з С3Н6:
Просторова ізомерія алкенів
Обертання атомів навколо подвійного зв'язку неможливе без її розриву. Це зумовлено особливостями будови p-зв'язку (p-електронна хмара зосереджена над та під площиною молекули). Внаслідок жорсткої закріпленості атомів поворотна ізомерія щодо подвійного зв'язку не виявляється. Але стає можливим цис-транс-ізомерія.
Алкени, що мають у кожного з двох атомів вуглецю при подвійному зв'язку різні замісники, можуть існувати у вигляді двох просторових ізомерів, що відрізняються розташуванням замісників щодо площини p-зв'язку. Так, у молекулі бутена-2 СН3-СН = СН-СН3групи СН3 можуть бути або по одну сторону від подвійного зв'язку в цис-ізомері, або по різні сторони транс-ізомері.

УВАГА! цис-транс- Ізомерія не проявляється, якщо хоча б один із атомів С при подвійному зв'язку має 2 однакових заступника.
Наприклад,
бутен-1 СН2 = СН-СН2-СН3не має цис- І транс-Ізомерів, т.к. 1-й атом пов'язаний з двома однаковими атомами Н.
Ізоміри цис- І транс- відрізняються не лише фізичними
 ,
,
а й хімічними властивостями, т.к. зближення чи видалення частин молекули друг від друга у просторі сприяє чи перешкоджає хімічному взаємодії.
Іноді цис-транс-ізомерію не зовсім точно називають геометричною ізомерією. Неточність полягає в тому, що всіпросторові ізомери відрізняються своєю геометрією, а не лише цис- І транс-.
5. Номенклатура
Алкени простої будови часто називають, замінюючи суфікс -ан в алканах на -ілен: етан - етилен,пропан - пропілен і т.д.
За систематичною номенклатурою назви етиленових вуглеводнів виробляють заміною суфікса -ан у відповідних алканах на суфікс -ен (алкан - алкен, етан - етен, пропан - пропен і т.д.). Вибір головного ланцюга та порядок назви той самий, що й для алканів. Однак до складу ланцюга повинен обов'язково входити подвійний зв'язок. Нумерацію ланцюга починають з того кінця, до якого ближче розташований цей зв'язок. Наприклад:

Ненасичені (алкенові) радикали називають тривіальними назвами або за систематичною номенклатурою:
(Н2С = СН-) вініл або етеніл
(Н2С = СН-СН2) аліл
До ненасичених відносять вуглеводні, що містять в молекулах кратні зв'язки між атомами вуглецю. Ненасичені алкени, алкіни, алкадієни (полієни). Ненасиченим характером мають також циклічні вуглеводні, що містять подвійний зв'язок в циклі ( циклоалкени), а також циклоалкани з невеликим числом атомів вуглецю в циклі (три або чотири атоми). Властивість «ненасиченості» пов'язане зі здатністю цих речовин вступати в реакції приєднання, насамперед водню, з утворенням граничних або насичених вуглеводнів - алканів.
Будова алкенів
Ациклічні вуглеводні, що містять у молекулі крім одинарних зв'язків, один подвійний зв'язок між атомами вуглецю та відповідні загальній формулі СnН2n. Своя друга назва - олефіни- алкени отримали за аналогією з жирними ненасиченими кислотами (олеїнова, лінолева), залишки яких входять до складу рідких жирів - масел.
Атоми вуглецю, між якими є подвійний зв'язок, перебувають у стані sр 2 -гібридизації. Це означає, що в гібридизації беруть участь одна s- та дві р-орбіталі, а одна р-орбіталь залишається негібридизованою. Перекриття гібридних орбіталей призводить до утворення σ-зв'язку, а за рахунок негібридизованих р-орбіталей
сусідніх атомів вуглецю утворюється другий, π-зв'язок. Таким чином, подвійний зв'язок складається з одного σ- та одного π - зв'язку. Гібридні орбіталі атомів, що утворюють подвійний зв'язок, знаходяться в одній площині, а орбіталі, що утворюють π-зв'язок, розташовуються перпендикулярно до площини молекули. Подвійний зв'язок (0,132 їм) коротше одинарної, а її енергія більша, тому що вона є міцнішою. Тим не менш, наявність рухомого, легко поляризується π-зв'язку призводить до того, що алкени хімічно активніші, ніж алкани, і здатні вступати в реакції приєднання.

Будова етилену

Утворення подвійного зв'язку в алкенах
Гомологічний ряд етену
Нерозгалужені алкени становлять гомологічний ряд етену ( етилену): З 2 Н 4 - етен, З 3 Н 6 - пропен, З 4 Н 8 - бутен, З 5 Н 10 - пентен, З 6 Н 12 - гексен, З 7 Н 14 - гептен і т.д.
Ізомерія алкенів
Для алкенів характерна структурна ізомерія. Структурні ізомери відрізняються один від одного будовою вуглецевого скелета. Найпростіший алкен, для якого характерні структурні ізомери, - це бутен:

Особливим видом структурної ізомерії є ізомерія положення подвійного зв'язку:
Алкени ізомерні циклоалканам (міжкласова ізомерія), наприклад:

Навколо одинарного вуглець-вуглецевого зв'язку можливе практично вільне обертання атомів вуглецю, тому молекули алканів можуть набувати найрізноманітнішої форми. Обертання навколо подвійного зв'язку неможливе, що призводить до появи у алкенів ще одного виду ізомерії - геометричної, або цис-і транс-ізомерії.


Цис-ізомеривідрізняються від транс-ізомерівпросторовим розташуванням фрагментів молекули (у разі метильних груп) щодо площині π -зв'язку, отже, і властивостями.
Номенклатура алкенів
1. Вибір головного кола.Утворення назви вуглеводню починається з визначення головного ланцюга - найдовшого ланцюжка атомів вуглецю в молекулі. У разі алкенів головний ланцюг повинен містити подвійний зв'язок.
2. Нумерація атомів головного кола.Нумерація атомів головного ланцюга починається з того кінця, до якого ближче перебуває подвійний зв'язок.
Наприклад, правильна назва з'єднання:
![]()
Якщо за становищем подвійного зв'язку не можна визначити початок нумерації атомів у ланцюзі, його визначає положення заступників як і, як граничних вуглеводнів.

3. Формування назви.В кінці назви вказують номер атома вуглецю, у якого починається подвійний зв'язок, та суфікс -єн, Що означає належність з'єднання до класу алкенів. Наприклад:

Фізичні властивості алкенів
Перші три представники гомологічного ряду алкенів – гази; речовини складу С5Н10 - С16Н32 - рідини; вищі алкени - тверді речовини.
Температури кипіння та плавлення закономірно підвищуються зі збільшенням молекулярної маси сполук.
Хімічні властивості алкенів
Реакції приєднання. Нагадаємо, що відмінною рисоюПредставників ненасичених вуглеводнів - алкенів є здатність вступати в реакції приєднання. Більшість цих реакцій протікає механізмом електрофільного приєднання.
1. Гідрування алкенів.Алкени здатні приєднувати водень у присутності каталізаторів гідрування, металів - платини, паладію, нікелю:
Ця реакція протікає при атмосферному та підвищеному тиску і не вимагає високої температури, оскільки є екзотермічною. При підвищенні температури на тих же каталізаторах може бути зворотна реакція - дегідрування.
2. Галогенування (приєднання галогенів). Взаємодія алкену з бромною водою або розчином брому в органічному розчиннику (СС14) призводить до швидкого знебарвлення цих розчинів в результаті приєднання молекули галогену до алкену та утворення дигалогеналканів.
3. Гідрогалогенування (приєднання галогеноводороду).
Ця реакція підпорядковується
При приєднанні галогеноводороду до алкену водень приєднується до більш гидрированному атому вуглецю, т. е. атому, у якому перебуває більше атомів водню, а галоген - менш гидрированному.


4. Гідратація (приєднання води).Гідратація алкенів призводить до утворення спиртів. Наприклад, приєднання води до етену є основою одного з промислових способів отримання етилового спирту.
Зверніть увагу на те, що первинний спирт (з гідроксогрупою при первинному вуглеці) утворюється тільки при гідратації етену. При гідратації пропену або інших алкенів утворюються вторинні спирти.

Ця реакція протікає також відповідно до правила Марковникова - катіон водню приєднується до більш гідрованого атома вуглецю, а гідроксогрупа - до менш гідрованого.
5. Полімеризація.Особливим випадком приєднання є реакція полімеризації алкенів:
Ця реакція приєднання протікає вільнорадикальним механізмом.
Реакція окислення.
1. Горіння.Як і будь-які органічні сполуки, алкени горять у кисні з утворенням СО2 та Н2О:
2. Окислення у розчинах.На відміну від алканів алкени легко окислюються під впливом розчинів перманганату калію. У нейтральних або лужних розчинах відбувається окислення алкенів до діолів (двохатомних спиртів), причому гідроксильні групи приєднуються до тих атомів, між якими до окислення існував подвійний зв'язок:




Найпростішим алкеном є етен C2H4. За номенклатурою IUPAC назви алкенів утворюються від назв відповідних алканів заміною суфікса «-ан» на «-ен»; становище подвійного зв'язку вказується арабською цифрою.


Просторова структура етилену
За назвою першого представника цього ряду – етилену – такі вуглеводні називають етиленовими.
Номенклатура та ізомерія
Номенклатура
Алкени простої будови часто називають, замінюючи суфікс -ан в алканах на -ілен: етан - етилен, пропан - пропілен і т.д.
За систематичною номенклатурою назви етиленових вуглеводнів виробляють заміною суфікса -ан у відповідних алканах на суфікс -ен (алкан - алкен, етан - етен, пропан - пропен і т.д.). Вибір головного ланцюга та порядок назви той самий, що й для алканів. Однак до складу ланцюга повинен обов'язково входити подвійний зв'язок. Нумерацію ланцюга починають з того кінця, до якого ближче розташований цей зв'язок. Наприклад:


Іноді використовують і раціональні назви. У цьому випадку всі алкенові вуглеводні розглядають як заміщені етилени:

Ненасичені (алкенові) радикали називають тривіальними назвами або за систематичною номенклатурою:
Н 2 С = СН - - вініл (етеніл)
Н 2 С = CН - СН 2 - -аліл (пропеніл-2)
Ізомерія
Для алкенів характерні два види структурної ізомерії. Крім ізомерії, пов'язаної з будовою вуглецевого скелета (як у алканів), з'являється ізомерія, яка залежить від положення подвійного зв'язку в ланцюзі. Це призводить до збільшення числа ізомерів у ряді алкенів.
Перші два члени гомологічного ряду алкенів -(етилен і пропілен) - ізомерів немає і їх будова можна так:
H 2 C = CH 2 етилен (етен)
H 2 C = CH - CH 3 пропілен (пропен)
Ізомерія положення кратного зв'язку
H 2 C = CH - CH 2 - CH 3 бутен-1
H 3 C - CH = CH - CH 3 бутен-2
Геометрична ізомерія - цис-, транс-ізомерія.
Така ізомерія характерна для з'єднань з подвійним зв'язком.
Якщо простий зв'язок допускає вільне обертання окремих ланок вуглецевого ланцюга навколо своєї осі, то навколо подвійного зв'язку такого обертання не відбувається. Це і є причиною появи геометричних ( цис-, транс-) ізомерів.
Геометрична ізомерія – один із видів просторової ізомерії.
Ізомери, у яких однакові заступники (при різних вуглецевих атомах) розташовані по одну сторону від подвійного зв'язку, називають цис-ізомерами, а по-різну - транс-ізомерами:


Цис-і транс-ізомери відрізняються не лише просторовою будовою, а й багатьма фізичними та хімічними властивостями. Транс-ізомери більш стійкі, ніж цис-ізомери.
Отримання алкенів
У природі алкени трапляються рідко. Зазвичай газоподібні алкени (етилен, пропілен, бутилени) виділяють із газів нафтопереробки (при крекінгу) або попутних газів, а також із газів коксування вугілля.
У промисловості алкени отримують дегідруванням алканів у присутності каталізатора (Сr 2 Про 3).
Дегідрування алканів
H 3 C - CH 2 - CH 2 - CH 3 → H 2 C = CH - CH 2 - CH 3 + H 2 (бутен-1)
H 3 C - CH 2 - CH 2 - CH 3 → H 3 C - CH = CH - CH 3 + H 2 (бутен-2)
З лабораторних способів одержання можна відзначити такі:
1. Відщеплення галогеноводороду від галогеналкілів при дії на них спиртового розчину лугу:
2. Гідрування ацетилену в присутності каталізатора (Pd):
H-C ≡ C-H + H 2 → H 2 C = CH 2
3. Дегідратація спиртів (відщеплення води).
Як каталізатор використовують кислоти (сірчану або фосфорну) або Аl 2 O 3:
У таких реакціях водень відщеплюється від найменш гідрогенізованого (з найменшою кількістю водневих атомів) вуглецевого атома (правило А.М.Зайцева):

Фізичні властивості
Фізичні властивості деяких алкенів показані у таблиці нижче. Перші три представники гомологічного ряду алкенів (етилен, пропілен і бутилен) - гази, починаючи з C 5 H 10 (амілен, або пентен-1) - рідини, а З 18 Н 36 - тверді речовини. Зі збільшенням молекулярної маси підвищуються температури плавлення та кипіння. Алкени нормальної будови киплять при вищій температурі, ніж їх ізомери, що мають ізобудування. Температури кипіння цис-ізомерів вище, ніж транс-ізомерів, а температури плавлення – навпаки.
Алкени погано розчиняються у воді (проте краще, ніж відповідні алкани), але добре - в органічних розчинниках. Етилен і пропілен горять полум'ям, що коптить.
Фізичні властивості деяких алкенів
Назва |
tпл, ° С |
tкіп, ° С |
||
Етилен (етен) |
||||
Пропілен (пропен) |
||||
Бутілен (бутен-1) |
||||
Ціс-бутен-2 |
||||
Транс-бутен-2 |
||||
Ізобутилен (2-метилпропен) |
||||
Амілен (пентен-1) |
||||
Гексилен (Гексен-1) |
||||
Гептилен (гептен-1) |
||||
Октілен (октен-1) |
||||
Нонілен (нонен-1) |
||||
Децилен (децен-1) |
Алкени малополярні, але легко поляризуються.
Хімічні властивості
Алкени мають значну реакційну здатність. Їх Хімічні властивостівизначаються, головним чином, подвійний вуглець-вуглецевий зв'язок.
π-зв'язок, як найменш міцна і доступніша, при дії реагенту розривається, а валентності вуглецевих атомів, що звільнилися, витрачаються на приєднання атомів, з яких складається молекула реагенту. Це можна уявити у вигляді схеми:

Таким чином, при реакціях приєднання подвійний зв'язок розривається наполовину (зі збереженням σ-зв'язку).
Для алкенів, крім приєднання, характерні реакції окислення і полімеризації.
Реакції приєднання
Найчастіше реакції приєднання йдуть за гетеролітичним типом, будучи реакціями електрофільного приєднання.
1. Гідрування (приєднання водню). Алкени, приєднуючи водень у присутності каталізаторів (Pt, Pd, Ni), переходять у граничні вуглеводні - алкани:
Н 2 С = СН 2 + H 2 → Н 3 С - СН 3 (етан)
2. Галогенування (приєднання галогенів). Галогени легко приєднуються за місцем розриву подвійного зв'язку з утворенням дигалогенопохідних:
Н 2 С = СН 2 + Cl 2 → ClH 2 C - CH 2 Cl (1,2-дихлоретан)
Легше йде приєднання хлору та брому, важче – йоду. Фтор з алкенами, як і з алканами, взаємодіє із вибухом.



Порівняйте: у алкенів реакція галогенування - процес приєднання, а чи не заміщення (як в алканов).
Реакцію галогенування зазвичай проводять у розчиннику за нормальної температури.
Приєднання брому та хлору до алкенів відбувається за іонним, а не за радикальним механізмом. Цей висновок випливає з того, що швидкість приєднання галогену не залежить від опромінення, присутності кисню та інших реагентів, що ініціюють або пригнічують радикальні процеси. На підставі великої кількостіекспериментальних даних цієї реакції було запропоновано механізм, що включає кілька послідовних стадій. У першій стадії відбувається поляризація молекули галогену під впливом електронів π-зв'язку. Атом галогену, що набуває деякий позитивний дробовий заряд, утворює з електронами π-зв'язку нестабільний інтермедіат, званий π-комплексом або комплексом з переносом заряду. Слід зазначити, що в π-комплексі галоген не утворює спрямованого зв'язку з якимсь конкретним атомом вуглецю; у цьому комплексі просто реалізується донорно-акцепторна взаємодія електронної пари π-зв'язку як донора та галогену як акцептора.

Далі π-комплекс перетворюється на циклічний бромонієвий іон. У процесі утворення цього циклічного катіону відбувається гетеролітичний розрив зв'язку Br-Br та порожня. р-орбіталь sp 2 -гібридизованого атома вуглецю перекривається з р-орбіталлю "неподіленої пари" електронів атома галогену, утворюючи циклічний іон бромонію.

На останній, третій стадії аніон брому як нуклеофільний агент атакує один із атомів вуглецю бромонієвого іона. Нуклеофільна атака бромід-іона призводить до розкриття тричленного циклу та утворення віцинального диброміду ( vic-Поряд). Цю стадію формально можна розглядати як нуклеофільне заміщення S N 2 у атома вуглецю, де групою, що йде, є Br + .

Результат цієї реакції неважко передбачити: аніон брому атакує карбкатіон з утворенням диброметану.
Швидке знебарвлення розчину брому в СCl 4 служить одним із найпростіших тестів на ненасиченість, оскільки і алкени, і алкіни, і дієни швидко реагують з бромом.
Приєднання брому до алкенів (реакція бромування) – якісна реакція на граничні вуглеводні. При пропусканні через бромну воду (розчин брому у воді) ненасичених вуглеводнів жовте забарвлення зникає (у разі граничних - зберігається).
3. Гідрогалогенування (приєднання галогеноводородів). Алкени легко приєднують галогенводні:
H 2 С = СН 2 + НВr → Н 3 С - CH 2 Вr
Приєднання галогенводнів до гомологів етилену йде за правилом В.В.Марковникова (1837 - 1904): за звичайних умов водень галогенводню приєднується за місцем подвійного зв'язку до найбільш гідрогенізованого атома вуглецю, а галоген - до менш гідрогенізованого:

Правило Марковникова можна пояснити тим, що несиметричних алкенів (наприклад, в пропілені) електронна щільність розподілена нерівномірно. Під впливом метильної групи, пов'язаної безпосередньо з подвійним зв'язком, відбувається зміщення електронної щільності у бік зв'язку (на крайній вуглецевий атом).
Внаслідок такого усунення p-зв'язок поляризується і на вуглецевих атомах виникають часткові заряди. Легко припустити, що позитивно заряджений іон водню (протон) приєднається до атома вуглецю (електрофільне приєднання), що має частковий негативний заряд, а аніон брому - до вуглецю з частковим позитивним зарядом.
Таке приєднання є наслідком взаємного впливу атомів в органічній молекулі. Як відомо, електронегативність атома вуглецю трохи вища, ніж водню.
Тому у метильній групі спостерігається деяка поляризація σ -зв'язків С-Н, пов'язана зі зміщенням електронної густини від водневих атомів до вуглецю У свою чергу це викликає підвищення електронної щільності в області подвійного зв'язку і особливо на крайньому атомі. Таким чином, метильна група, як і інші алкільні групи, виступає як донор електронів. Однак у присутності пероксидних сполук або Про 2 (коли реакція має радикальний характер) ця реакція може і проти правила Марковникова.
З тих самих причин правило Марковникова дотримується при приєднанні до несиметричних алкенів як галогеноводородів, а й інших електрофільних реагентів (H 2 O, H 2 SО 4 , НОСl, ICl та інших.).
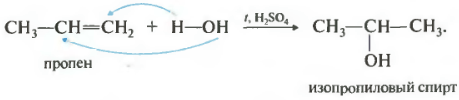
4. Гідратація (приєднання води). У присутності каталізаторів до алкенів приєднується вода із утворенням спиртів. Наприклад:
H 3 C - CH = CH 2 + H - OH → H 3 C - CHOH - CH 3 (ізопропіловий спирт)
Реакції окиснення
Алкени окислюються легше, ніж алкани. Продукти, утворені при окисленні алкенів, та його будова залежить від будови алкенів і зажадав від умов проведення цієї реакції.
1. Горіння
Н 2 С = СН 2 + 3O 2 → 2СO 2 + 2Н 2 O
2. Неповне каталітичне окиснення

3. Окислення за нормальної температури. При дії на етилен водного розчину КМnO 4 (при нормальних умовах, в нейтральному або лужному середовищі - реакція Вагнера) відбувається утворення двоатомного спирту - етиленгліколю:
3H 2 C = CH 2 + 2KMnO 4 + 4H 2 O → 3HOCH 2 - CH 2 OH (етиленгліколь) + 2MnO 2 + KOH
Ця реакція є якісною: фіолетове фарбування розчину перманганату калію змінюється при додаванні до нього ненасиченої сполуки.
У більш жорстких умовах (окислення КМnO 4 у присутності сірчаної кислоти або хромової сумішшю) в алкені відбувається розрив подвійного зв'язку з утворенням кисневмісних продуктів:
H 3 C - CH = CH - CH 3 + 2O 2 → 2H 3 C - COOH (оцтова кислота)
Реакція ізомеризації
При нагріванні або при наявності каталізаторів алкени здатні ізомеризуватися - відбувається переміщення подвійного зв'язку або встановлення ізобудування.
Реакції полімеризації
За рахунок розриву π-зв'язків молекули алкену можуть з'єднуватись один з одним, утворюючи довгі ланцюгові молекули.

Знаходження в природі та фізіологічна роль алкенів
У природі ациклічні алкени мало зустрічаються. Найпростіший представник цього класу органічних сполук - етилен C 2 H 4 - є гормоном для рослин і в незначній кількості синтезується в них.
Один з небагатьох природних алкенів - мускалур ( цис-трикозен-9) є статевим атрактантом самки домашньої мухи (Musca domestica).
Нижчі алкени у високих концентраціях мають наркотичний ефект. Вищі члени ряду також викликають судоми та подразнення слизових оболонок дихальних шляхів
Окремі представники
Етилен (етен) - органічна хімічна сполука, яка описується формулою С 2 H 4 . Є найпростішим алкеном. Містить подвійний зв'язок і тому відноситься до ненасичених або ненасичених вуглеводнів. Відіграє надзвичайно важливу роль у промисловості, а також є фітогормоном (низькомолекулярні) органічні речовини, що виробляються рослинами та мають регуляторні функції).
Етилен - викликає наркоз, має дратівливу і мутагенну дію.
Етилен - органічне з'єднання, що виробляється у світі; загальне світове виробництво етилену у 2008 році становило 113 мільйонів тонн і продовжує зростати на 2-3% на рік.
Етилен є провідним продуктом основного органічного синтезу та застосовується для отримання поліетилену (1-е місце, до 60% всього обсягу).
Поліетилен – термопластичний полімер етилену. Найпоширеніший у світі пластик.
Є воскоподібною масою білого кольору (тонкі листи прозорий безбарвні). Хімічно- і морозостійка, ізолятор, не чутливий до удару (амортизатор), при нагріванні розм'якшується (80-120°С), при охолодженні застигає, адгезія (зчеплення поверхонь різнорідних твердих та/або рідких тіл) - надзвичайно низька. Іноді в народній свідомостіототожнюється з целофаном – схожим матеріалом рослинного походження.
Пропілен - викликає наркоз (сильніше, ніж етилен), має загальнотоксичну та мутагенну дію.
Стійкий до дії води, що не реагує з лугами будь-якої концентрації, з розчинами нейтральних, кислих та основних солей, органічними та неорганічними кислотами, навіть концентрованої сірчаної кислоти, але розкладається при дії 50%-ої азотної кислотипри кімнатній температурі та під впливом рідкого та газоподібного хлору та фтору. Згодом відбувається термостаріння.
Поліетиленова плівка (особливо пакувальних, наприклад, пухирчаста упаковка або скотч).


Тара (пляшки, банки, ящики, каністри, садові лійки, горщики для розсади).
Полімерні труби для каналізації, дренажу, водо-, газопостачання.

Електроізоляційні матеріали.
Поліетиленовий порошок використовують як термоклей.

Бутен-2 - викликає наркоз, має подразнюючу дію.
ПОГРАНИЧНІ, АБО НЕНАСИЩЕНІ, ВУГЛЕВОДОРОДИ РЯДУ ЕТИЛЕНУ
(АЛКЕНИ, АБО ОЛЕФІНИ)
Алкени, або олефіни(Від лат. olefiant - олія - стара назва, але широко використовується в хімічній літературі. Приводом до такої назви послужив хлористий етилен, отриманий у XVIII столітті, - рідка масляниста речовина.) - аліфатичні ненасичені вуглеводні, в молекулах яких між вуглецевими атомами є один подвійний зв'язок.
Алкени містять у своїй молекулі менше водневих атомів, ніж відповідні їм алкани (з тим самим числом вуглецевих атомів), тому такі вуглеводні називають ненасиченимиабо ненасиченими.
Алкени утворюють гомологічний ряд із загальною формулою C n H 2n
1. Гомологічний ряд алкенів
|
З n H 2 n алкен |
Назви, суфікс ЄН, ІЛЕН |
|
C 2 Н 4 |
ет він, ет ілен |
|
C 3 H 6 |
пропен |
|
C 4 H 8 |
бутен |
|
C 5 H 10 |
пентен |
|
C 6 H 12 |
гексен |
Гомологи:
ЗH 2 = CH 2 Етен
ЗH 2 = CH- CH 3 пропен
ЗH 2 =CH-CH 2 -CH 3бутен-1
ЗH 2 =CH-CH 2 -CH 2 -СН 3 пентен-1
2. Фізичні властивості
Етилен (етен) – безбарвний газ з дуже слабким солодкуватим запахом, трохи легший за повітря, малорозчинний у воді.
З 2 – З 4 (гази)
З 5 – З 17 (рідини)
З 18 - (тверді)
· Алкени не розчиняються у воді, розчинні в органічних розчинниках (бензин, бензол та ін.)
· Легше води
· Зі збільшенням Mr температури плавлення та кипіння збільшуються
3. Найпростішим алкеном є етилен - C 2 H 4
Структурна та електронна формули етилену мають вигляд:
У молекулі етилену піддаються гібридизації одна s- і дві p-орбіталі атомів C ( sp 2-гібридизація).
Таким чином, кожен атом C має по три гібридних орбіталі і по одній негібридній p-орбіталі. Дві з гібридних орбіталей атомів C взаємно перекриваються та утворюють між атомами C
σ – зв'язок. Інші чотири гібридних орбіталі атомів C перекриваються в тій же площині з чотирма. s-орбіталями атомів H і також утворюють чотири σ - зв'язок. Дві негібридні p-орбіталі атомів C взаємно перекриваються в площині, яка розташована перпендикулярно площині - зв'язок, тобто. утворюється одна П- Зв'язок.

За своєю природою П- Зв'язок різко відрізняється від σ - Зв'язок; П- зв'язок менш міцна внаслідок перекриття електронних хмар поза площиною молекули. Під дією реагентів П- Зв'язок легко розривається.
Молекула етилену симетрична; ядра всіх атомів розташовані в одній площині та валентні кути близькі до 120 °; відстань між центрами атомів C дорівнює 0,134 нм.
Якщо атоми з'єднані подвійним зв'язком, то їх обертання неможливе без того, щоб електронні хмари П- Зв'язок не розімкнулися.
4. Ізомерія алкенів
Поряд зі структурною ізомерією вуглецевого скелета для алкенів характерні, по-перше, інші різновиди структурної ізомерії. ізомерія положення кратного зв'язкуі міжкласова ізомерія.
По-друге, у ряді алкенів проявляється просторова ізомерія , пов'язана з різним становищем заступників щодо подвійного зв'язку, навколо якого неможливе внутрішньомолекулярне обертання
Структурна ізомерія алкенів
1. Ізомерія вуглецевого скелета (починаючи з 4 Н 8):
2. Ізомерія положення подвійного зв'язку (починаючи з 4 Н 8):
3. Міжкласова ізомерія з циклоалканами, починаючи з 3 Н 6:
Просторова ізомерія алкенів
Обертання атомів навколо подвійного зв'язку неможливе без її розриву. Це зумовлено особливостями будови p-зв'язку (p-електронна хмара зосереджена над та під площиною молекули). Внаслідок жорсткої закріпленості атомів поворотна ізомерія щодо подвійного зв'язку не виявляється. Але стає можливим цис-транс-ізомерія.
Алкени, що мають у кожного з двох атомів вуглецю при подвійному зв'язку різні замісники, можуть існувати у вигляді двох просторових ізомерів, що відрізняються розташуванням замісників щодо площини p-зв'язку. Так, у молекулі бутена-2 СН 3 -СН = СН-СН 3групи СН 3 можуть знаходитися або по один бік від подвійного зв'язку цис-ізомері, або по різні сторони транс-ізомері.

УВАГА!
цис-транс- Ізомерія не проявляється, якщо хоча б один із атомів С при подвійному зв'язку має 2 однакових заступника.
Наприклад,
бутен-1 СН 2 = СН-СН 2 -СН 3не має цис- І транс-Ізомерів, т.к. 1-й атом пов'язаний з двома однаковими атомами Н.
Ізоміри цис- І транс- відрізняються не лише фізичними
 ,
,
а й хімічними властивостями, т.к. зближення чи видалення частин молекули друг від друга у просторі сприяє чи перешкоджає хімічному взаємодії.
Іноді цис-транс-ізомерію не зовсім точно називають геометричною ізомерією. Неточність полягає в тому, що всіпросторові ізомери відрізняються своєю геометрією, а не лише цис- І транс-.
5. Номенклатура
Алкени простої будови часто називають, замінюючи суфікс -ан в алканах на -ілен: етан - етилен,пропан - пропілен і т.д.
За систематичною номенклатурою назви етиленових вуглеводнів виробляють заміною суфікса -ан у відповідних алканах на суфікс -ен (алкан - алкен, етан - етен, пропан - пропен і т.д.). Вибір головного ланцюга та порядок назви той самий, що й для алканів. Однак до складу ланцюга повинен обов'язково входити подвійний зв'язок. Нумерацію ланцюга починають з того кінця, до якого ближче розташований цей зв'язок. Наприклад:

Ненасичені (алкенові) радикали називають тривіальними назвами або за систематичною номенклатурою:
(Н 2 С=СН-)вініл або етеніл
(Н 2 С=СН-СН 2) аліл



