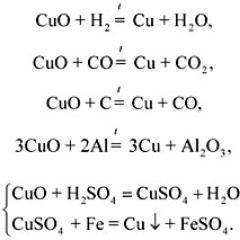Світ навколо нас. Відеоурок «Атомно-молекулярне вчення у хімії
Основи атомно-молекулярної теорії створили російський вчений М.В.Ломоносов (1741) і англійський вчений Дж. Дальтон (1808).
Атомно-молекулярна теорія – це вчення про будову речовини, основними положеннями якої є:
1. Усі речовини складаються з молекул та атомів. Молекула - це найменша частка речовини, яка здатна існувати самостійно і не може дробитися далі без втрати основних хімічних властивостей цієї речовини. Хімічні властивості молекули визначаються її складом та хімічною будовою.
2. Молекули перебувають у безперервному русі. Молекули рухаються безладно і безперервно. Швидкість руху молекул залежить від агрегатного стануречовин. З підвищенням температури швидкість руху молекул зростає.
3. Молекули однієї і тієї ж речовини однакові, а молекули різних речовинвідрізняються масою, розмірами, будовою та хімічними властивостями. Кожна речовина існує доти, доки зберігаються її молекули. Як тільки молекули руйнуються, перестає існувати і ця речовина: виникають нові молекули, нові речовини. При хімічних реакціяхмолекули одних речовин руйнуються, утворюються молекули інших речовин.
4. Молекули складаються з дрібніших частинок – атомів. Атом – це найменша частка хімічного елементане можна розкласти хімічним шляхом.
Отже, атом зумовлює властивості елемента.
атом– електронейтральна частка, що складається з позитивно зарядженого ядра та негативно заряджених електронів.
Хімічним елементомназивається вид атомів, що характеризуються певною сукупністю властивостей.
В даний час елемент визначається як вид атомів, що мають однаковий заряд ядра.
Речовини, молекули яких складаються з атомів одного елемента, називаються простими речовинами(З, Н 2, N 2, О 3, S 8 і т.д.).
Речовини, молекули яких складаються з атомів двох або більше елементів, називаються складними речовинами ( H 2 O, H 2 SO 4 KHCO 3 і т.д.). Істотне значення має число та взаємне розташуванняатомів у молекулі.
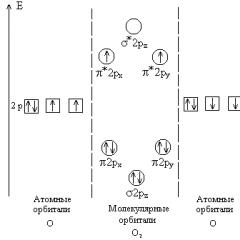
Здатність атомів одного і того ж елемента до утворення кількох простих речовин, різних за будовою та властивостями називається алотропією,а речовини, що утворилися – алотропними видозмінами або модифікаціями,так наприклад, елемент кисень утворює дві алотропні модифікації: 2 - кисень і 3 - озон; елемент вуглець – три: алмаз, графіт та карбін тощо.
Явище алотропии викликається двома причинами: різним числом атомів у молекулі (кисень Про 2 і озон Про 3), чи утворенням різних кристалічних форм (алмаз, графіт і карбін).
Елементи заведено позначати хімічними знаками. Слід завжди пам'ятати,що кожен знак хімічного елемента означає:
1. назва елемента;
2. один атом його;
3. одна моль його атомів;
4. відносну атомну масу елемента;
5. його становище у періодичній системі хімічних елементів
Д.І. Менделєєва.
Так, наприклад, знак Sпоказує, що маємо:
1. хімічний елемент сірки;
2. один атом його;
3. один моль атомів сірки;
4. атомна маса сірки дорівнює 32 а. е. м. (атомна одиниця маси);
5. порядковий номер у періодичній системі хімічних елементів Д.І. Менделєєва 16.
Абсолютні маси атомів і молекул дуже малі, тому для зручності масу атомів і молекул виражають у відносних одиницях. В даний час за одиницю атомних мас прийнято атомна одиниця маси(скорочено а. е. м.), що є 1/12 частиною маси ізотопу вуглецю 12 С, 1 а. е. м. складає 1,66 × 10 -27 кг.
Атомною масою елементаназивається маса його атома, виражена в а. е. м.
Відносною атомною масою елементаназивають відношення маси атома даного елемента до 1/12 маси ізотопу вуглецю 12 С.
Відносна атомна маса величина безрозмірна і позначається Аr,
наприклад, для водню ![]()
для кисню ![]() .
.
Молекулярна маса речовини- Це маса молекули, виражена в а. е. м. Вона дорівнює сумі атомних мас елементів, що входять до складу молекули даної речовини.
Відносною молекулярною масою речовининазивають відношення маси молекули даної речовини до 1/12 маси ізотопу вуглецю 12 С. Вона позначається символом Мr.Відносна молекулярна маса дорівнює сумі відносних атомних мас елементів, що входять до молекули з урахуванням кількості атомів. Наприклад, відносна молекулярна маса ортофосфорної кислоти Н 3 РО 4 дорівнює масі атомів всіх елементів, що входять до молекули:
Мr(Н 3 РО 4) = 1,0079 × 3 + 30,974 × 1 + 15,9994 × 4 = 97, 9953 або ≈ 98
Відносна молекулярна маса показує, у скільки разів маса молекули даної речовини більша за 1 а. е.м.
Поряд з одиницями маси, у хімії користуються також одиницею кількості речовини, яка називається молимо(скорочене позначення «моль»).
Міль речовини– кількість речовини, що містить стільки молекул, атомів, іонів, електронів або інших структурних одиниць, скільки міститься у 12 г (0,012 кг) ізотопу вуглецю 12°С.
Знаючи масу одного атома вуглецю 12 С (1,993 × 10 -27 кг), можна обчислити число атомів 0,012 кг вуглецю:
![]()
Число частинок в молі будь-якої речовини те саме. Воно дорівнює 6,02 × 10 23 і називається постійної Авогадроабо числом Авогадро (N А).
Наприклад, в трьох моль атомів вуглецю буде міститься
3 × 6,02 × 10 23 = 18,06 × 10 23 атомів
Застосовуючи поняття «моль», необхідно у кожному конкретному випадку точно вказати, які саме структурні одиниці маються на увазі. Наприклад, слід розрізняти моль атомів водню Н, моль молекул водню Н 2 , моль іонів водню або Один моль частинок має певну масу.
Молярна маса- Це маса одного молячи речовини. Позначається буквою М.
Молярна маса чисельно дорівнює відносної молекулярної маси та має одиниці виміру г/моль або кг/моль.
Маса та кількість речовини – поняття різні. Маса виявляється у кг (г), а кількість речовини – в молях. Між масою речовини (m, г), кількістю речовини (n, моль) та молярною масою (М, г/моль) існують співвідношення:
n = , г/моль; М = , г/моль; m = n × M, р.
За цими формулами легко обчислити масу певної кількості речовини, молярну масу речовини чи кількості речовини.
Приклад 1 . Чому дорівнює маса 2 моль атомів заліза?
Рішення: Атомна маса заліза дорівнює 56 а. (округлено), отже, 1 моль атомів заліза важить 56 г, а 2 моль атомів заліза мають масу 56×2 = 112 г
Приклад 2 . Скільки моль гідроксиду калію міститься в 560 г КОН?
Рішення: Молекулярна маса КОН дорівнює 56 а. Молярна = 56 г/моль. У 560 г гідроксиду калію міститься: 10 моль КОН. Для газоподібних речовиніснує поняття молярний обсяг V m. Відповідно до закону Авогадро моль будь-якого газу при нормальних умовах(тиск 101,325 кПа та температурі 273К) займає об'єм 22,4 л. Ця величина називається молярним об'ємом(його займають 2 г водню (Н 2), 32 г кисню (Про 2) тощо.
Приклад 3 . Визначити масу 1 л оксиду вуглецю (ΙV) за нормальних умов (н. у.).
Рішення: Молекулярна маса 2 дорівнює М = 44 а.е.м., отже, молярна маса дорівнює 44 г/моль. За законом Авогадро один моль СО 2 за н.у. займає об'єм 22,4 л. Звідси маса 1 л СО 2 (н. у.) дорівнює р.
приклад 4. Визначити об'єм, який займає 3,4 г сірководню (Н 2 S) за нормальних умов (н.у.).
Рішення: Молярна маса сірководню дорівнює 34 г/моль. Виходячи з цього можна записати: 34 г Н 2 S при н.у. займає об'єм 22,4 л.
3,4 г ________________________ Х л,
звідси Х = ![]() л.
л.
Приклад 5. Скільки молекул аміаку міститься:
а) в 1 л; б) в 1 г?
Рішення: Число Авогадро 6,02 × 10 23 вказує на кількість молекул в 1 молі (17 г/моль) або 22,4 л при н.у., отже, в 1 л міститься
6,02 × 10 23 × 1= 2,7 × 1022 молекул.
Число молекул аміаку в 1 г знаходимо з пропорції:
звідси Х = 6,02 × 10 23 × 1= 3,5 × 1022 молекул.
Приклад 6. Яка маса 1 моль води?
Рішення: Молекулярна маса води H 2 O дорівнює 18 а. (Атомна маса водню – 1, кисню – 16, разом 1 + 1 + 16 = 18). Отже, один моль води дорівнює масою 18 грамів, і ця маса води містить 6,02 × 10 23 молекул води.
Кількісно маса 1 моль речовини – маса речовини у грамах, чисельно рівна його атомної чи молекулярної масі.
Наприклад, маса 1 молячи сірчаної кислоти H 2 SO 4 дорівнює 98 г
(1 +1 + 32 + 16 + 16 + 16 + 16 = 98),
а маса однієї молекули H 2 SO 4 дорівнює 98 г= 16,28 × 10 -23 г
Таким чином, будь-яке хімічне з'єднанняхарактеризується масою одного моля або мольною (молярною) масою М, що виражається в г/моль (М(H 2 O) = 18 г/моль, а М(H 2 SO 4) = 98 г/моль).
Тема лекції: ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ.
План:
ОСНОВНІ ПОНЯТТЯ ХІМІЇ. АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ
ОСНОВНІ ЗАКОНИ ХІМІЇ
ОСНОВНІ ГАЗОВІ ЗАКОНИ
ХІМІЧНИЙ ЕКВІВАЛЕНТ. ЗАКОН ЕКВІВАЛЕНТНИХ ВІДНОСИН
ХІМІЧНІ РЕАКЦІЇ. КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ
МІСЦЕ ХІМІЇ СЕРЕД ІНШИХ НАУК
Хімія відноситься до природничих наук, що вивчають навколишній матеріальний світ, його явища та закони.
Основним законом природи є закон вічності матерії та її руху. Окремі формирухи матерії вивчаються окремими науками. Місце хімії, що має справу головним чином з молекулярним (і атомним) рівнем організації матерії, між фізикою елементарних частинок (субатомний рівень) та біологією (надмолекулярний рівень).
Хімія- наука про речовини, їх склад, будову, властивості і перетворення, пов'язані зі зміною складу, будови і властивостей частинок, що їх утворюють.
Великий російський учений М. У. Ломоносов сказав: «Широко простягає хімія руки свої у людські справи». Справді, практично немає жодної технічної дисципліни, яка б обійтися без знань хімії. Навіть такі сучасні та далекі, здавалося б, хімії науки, як електроніка, інформатика, сьогодні отримали новий імпульс у своєму розвитку, уклавши «союз» з хімією (запис інформації на молекулярному рівні, розробка біокомп'ютерів та ін.). Що тоді говорити про фундаментальні дисципліни: фізику, біологію та ін., де давно існують самостійні розділи, прикордонні з хімією (хімічна фізика, біохімія, геохімія та ін.).
ОСНОВНІ ПОНЯТТЯ ХІМІЇ.
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ
Уявлення про атоми, як конструкційні елементи речовинного світу, зародилося ще в стародавньої Греції(Левкіпп, Демокріт, 1У-Ш ст. до н. е.). Але тільки наприкінці XVIII - початку XIXв. було створено атомно-молекулярне вчення. Найважливіший внесок у узагальнення накопиченого матеріалу було зроблено М. У. Ломоносовим.
Атомно-молекулярне вчення включає такі основні положення:
1. Усі речовини є суцільними, а складаються з частинок (молекул, атомів, іонів).
2. Молекули складаються з атомів (елементів).
3. Відмінності між речовинами визначаються відмінностями частинок, що їх утворюють, які відрізняються один від одного складом, будовою і властивостями.
4. Усі частки перебувають у постійному русі, швидкість якого збільшується під час нагрівання.
атом- Найменша частка хімічного елемента, яка є носієм його властивостей. Це електронейтральна мікросистема, поведінка якої підпорядковується законам квантової механіки.
Хімічний елемент- Вид атомів, що мають однаковий позитивний заряд ядра і характеризуються певною сукупністю властивостей.
Ізотопи- Атоми одного елемента, що відрізняються масою (кількістю нейтронів в ядрі).
Будь-який хімічний елемент у природі представлений певним ізотопним складом, тому його маса розраховується як певна середня величиназ мас ізотопів з урахуванням їх утримання у природі.
Молекула- найменша частка речовини, що є носієм її властивостей і здатна до самостійного існування.
Проста речовина- Речовина, молекули якої складаються тільки з атомів одного елемента.
Алотропія- здатність елемента утворити прості речовини, що мають різний склад, будову та властивості.
Різновиди алотропних модифікацій визначаються:
Різним числом атомів елемента у складі молекули простої речовини, наприклад, кисень (2) і озон (3).
Відмінностями у будові кристалічних ґратпростої речовини, наприклад, сполуки вуглецю: графіт (плоска, або двовимірна, решітка) та алмаз (об'ємна, або тривимірна решітка).
Складна речовина- Речовина, молекули якої складаються з атомів різних елементів.
Складні речовини, що складаються лише з двох елементів, називаються бінарними, наприклад:
Ø оксиди: CO, CO2, CaO, Na2O, FeO, Fe2O3;
Ø сульфіди: ZnS, Na 2 S, CS 2;
Ø гідриди: CaH 2 , LiH, NaH;
Ø нітриди: Li 3 N, Ca 3 N 2 AlN;
фосфіди: Li 3 P, Mg 3 P 2 , AlP;
Ø карбіди: Be 2 C, Al 4 C 3, Ag 2 C 2;
Ø силіциди: Ca 2 Si, Na 4 Si.
Складні сполуки, що складаються з більш ніж двох елементів, відносяться до основних класів неорганічних сполук. Це гідроксиди (кислоти та основи) та солі, у тому числі комплексні сполуки.
Атоми і молекули мають абсолютну масу, наприклад, маса атома 12 дорівнює 2·10 -26 кг.
Такими величинами користуватися практично незручно, у хімії прийнято відносна шкала мас.
Атомна одиниця маси(а. е. м.) дорівнює 1/12 маси ізотопу З 12 .
Відносна атомна маса (А r- безрозмірна величина) дорівнює відношенню середньої маси атома а. е. м.
Відносна молекулярна маса (М r- безрозмірна величина) дорівнює відношенню середньої маси молекули а. е. м.
Міль(ν - «ню» або n) - кількість речовини, що містить стільки ж структурних одиниць (атомів, молекул або іонів), скільки атомів міститься в 12 г ізотопу С 12 .
Число Авогадро- Число частинок (атомів, молекул, іонів та ін), що міститься в 1 молі будь-якої речовини.
N A = 6,02 · 10 23 .
Більше точні значеннядеякі фундаментальні константи наводяться в таблицях додатка.
Молярна маса речовини (М)- це маса 1 молячи речовини. Вона розраховується як відношення маси речовини до її кількості:
Молярна маса чисельно дорівнює А r(для атомів) або М r(Для молекул).
З рівняння 1 можна визначити кількість речовини, якщо відомі її маса та молярна маса:
![]() (2)
(2)
Молярний об'єм (V mдля газів) – обсяг одного молячи речовини. Розраховується як відношення обсягу газу до його кількості:
![]() (3)
(3)
Об'єм 1 моля будь-якого газу за нормальних умов (Р = 1атм = 760 мм. рт. ст. = 101,3 кПа; T = 273ТС = 0 ° С) дорівнює 22,4 л.
![]() (4)
(4)
Щільність речовини дорівнює відношенню її до обсягу.
![]() (5)
(5)
У розвиток атомно-молекулярного вчення великий внесок М. В. Ломоносов, Дж. Дальтон, А. Лавуазьє, Ж. Пруст, А. Авогадро, Й. Берцеліус, Д. І. Менделєєв, А. М. Бутлеров. Перший визначив хімію як науку М. В. Ломоносова. Ломоносов створив вчення про будову речовини, заклав основу атомно-молекулярної теорії. Воно зводиться до таких положень:
1. Кожна речовина складається з найдрібніших, далі фізично неподільних частинок (Ломоносов називав їх корпускулами, згодом їх назвали молекулами).
2. Молекули перебувають у постійному, мимовільному русі.
3. Молекули складаються з атомів (Ломоносов назвав їх елементами).
4. Атоми характеризуються певним розміром та масою.
5. Молекули можуть складатися як із однакових, і різних атомів.
Молекула - це найменша частка речовини, що зберігає її склад і Хімічні властивості. Молекула не може подрібнюватися далі без зміни хімічних властивостей речовини. Між молекулами речовини існує взаємне тяжіння, різне в різних речовин. Молекули в газах притягуються одна до одної дуже слабко, тоді як між молекулами рідких та твердих речовин сили тяжіння відносно великі. Молекули будь-якої речовини перебувають у безперервному русі. Цим явищем пояснюється, наприклад, зміна обсягу речовин під час нагрівання.
Атомами називаються дрібні, хімічно неподільні частки, у тому числі складаються молекули. Атом - це найменша частка елемента, що зберігає його хімічні властивості. Атоми відрізняються зарядами ядер, масою та розмірами. За хімічних реакцій атоми не виникають і не зникають, а утворюють молекули нових речовин. Елемент слід як вид атомів з однаковим зарядом ядра.
Хімічні властивості атомів однієї й тієї ж хімічного елемента однакові, такі атоми можуть відрізнятися лише масою. Різновиди атомів одного і того ж елемента з різною масою називаються ізотопами. Тому різновидів атомів більше, ніж хімічних елементів.
Необхідно розрізняти поняття "хімічний елемент" та "проста речовина".
Речовина - це певна сукупність атомних та молекулярних частинок у будь-якому з трьох агрегатних станів.
Агрегатні стани речовини - стан речовини, що характеризується певними властивостями (здатність зберігати форму, об'єм).
Виділяють три основні агрегатні стани: тверде тіло, рідина та газ. Іноді не зовсім коректно до агрегатних станів зараховують плазму. Існують і інші агрегатні стани, наприклад рідкі кристали або конденсат Бозе - Ейнштейна.
Хімічний елемент – це загальне поняттяпро атоми з однаковим зарядом ядра та хімічними властивостями.
Фізичні властивості, Характерні для простої речовини, хімічному елементу приписати не можна.
Прості речовини - це речовини, які з атомів однієї й тієї ж хімічного елемента. Один і той самий елемент може утворювати кілька простих речовин.
Сучасний виклад основних положень атомно-молекулярного вчення:
1. Усі речовини складаються з атомів.
2. Атоми кожного виду (елемента) однакові між собою, але від атомів будь-якого іншого виду (елемента).
3. При взаємодії атомів утворюються молекули: гомоядерні (за взаємодії атомів одного елемента) або гетероядерні (за взаємодії атомів різних елементів).
4. При фізичних явищах молекули зберігаються, при хімічних – руйнуються; при хімічних реакціях атоми на відміну молекул зберігаються.
5. Хімічні реакції полягають в утворенні нових речовин з тих самих атомів, з яких складаються початкові речовини.
ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
Речовини та їх властивості. Предмет хімії
Оглянемося довкола. Ми самі і все, що оточує нас, складається з речовин. Речовин дуже багато. Нині вчені знають близько 10 млн. органічних та близько 100 тис. неорганічних речовин. І всі вони характеризуються певними властивостями. Властивості речовини називаються ознаки, за якими речовини відрізняються одна від одної або подібні між собою.
Кожен окремий вид матерії, що має за цих умов певні фізичні властивості,наприклад, алюміній, сірка, вода, кисень, називають речовиною.
Хімія вивчає склад, будову, властивості та перетворення речовин. Глибоке знання хімії зовсім необхідне фахівцям усіх галузей народного господарства. Поряд із фізикою та математикою вона становить основу підготовки фахівців високої кваліфікації.
З речовинами відбуваються різні зміни, наприклад: випаровування води, плавлення скла, згоряння палива, іржавіння металів і т. д. Ці зміни з речовинами можна віднести до фізичнимабо до хімічним явищам.
Фізичними називають такі явища, при яких дані речовини не перетворюються на інші, а зазвичай змінюється тільки їх агрегатний стан або форма
Хімічними називають такі явища, у яких з цих речовин утворюються інші. Хімічні явища називаються хімічними перетвореннями чи хімічними реакціями
При хімічних реакціях вихідні речовини перетворюються на інші речовини, які мають інші властивості. Про це можна судити з зовнішніми ознаками хімічних реакцій: 1) виділення теплоти (іноді світла); 2) зміна забарвлення; 3) поява запаху; 4) утворення осаду; 5) виділення газу.
Атомно-молекулярне вчення
У XVIII – XIX ст. в результаті робіт М. В. Ломоносова, Дальтона, Авогадро та інших було висунуто гіпотезу про атомно-молекулярну будову речовини. Ця гіпотеза ґрунтується на ідеї про реальне існування атомів та молекул. У 1860 р. Міжнародний конгрес хіміків чітко визначив поняття атома та молекула.Атомно-молекулярне вчення прийняли усі вчені. Хімічні реакції почали розглядати з погляду атомно-молекулярного вчення. У наприкінці XIXта на початку XX ст. атомно-молекулярне вчення перетворилося на наукову теорію. У цей час вчені довели експериментально, що атоми та молекули існують об'єктивно, незалежно від людини.
В даний час, можливо, не тільки обчислити розміри окремих молекул їхньої маси, але й визначити порядок з'єднання атомів у молекулі. Вчені визначають відстань між молекулами та навіть фотографують деякі макромолекули. Також тепер відомо, що не всі речовини складаються із молекул.
Основні положення атомно-молекулярного вченняможна сформулювати так:
1. Існують речовини з молекулярною та немолекулярною будовою.
2. Молекула - це найменша частка речовини, яка зберігає його хімічні властивості.
3. Між молекулами існують проміжки, розміри яких залежать від агрегатного стану та температури.Найбільші відстані є між молекулами газів. Цим пояснюється їхня легка стисливість. Найважче стискаються рідини, де проміжки між молекулами значно менші. У твердих речовинах проміжки між молекулами ще менші, тому вони майже не стискаються.
4. Молекули перебувають у безперервному русі.Швидкість руху молекул залежить від температури. З підвищенням температури швидкість руху молекул зростає.
5. Між молекулами існують сили взаємного тяжіння та відштовхування.Найбільшою мірою ці сили виражені в твердих тілах, у найменшій – у газах.
6. Молекули складаються з атомів, які, як і молекули, перебувають у безперервному русі.
7 Атоми – це найдрібніші хімічно неподільні частки.
8. Атоми одного виду відрізняються від атомів іншого виду масою та властивостями. Кожен окремий вид атомів називається хімічним елементом.
9. При фізичних явищах молекули зберігаються, за хімічних, як правило, руйнуються.При хімічних реакціях відбувається перегрупування атомів.
Атомно-молекулярна теорія – одна з головних теорій природничих наук. Ця теорія підтверджує матеріальну єдність світу.
За сучасними уявленнями з молекул складаються речовини в газоподібному та пароподібному стані. У твердому (кристалічному) стані з молекул складаються лише речовини, що мають молекулярну структуру, наприклад органічні речовини, неметали (за невеликим винятком), оксид вуглецю (IV), вода. Більшість твердих (кристалічних) неорганічних речовин не має молекулярної структури. Вони складаються не з молекул, а з інших частинок (іонів, атомів) та існують у вигляді макротіл. Наприклад, багато солі, оксиди та сульфіди металів, алмаз, кремній, метали.
У речовин із молекулярною структурою хімічний зв'язокміж молекулами менш міцна, ніж атомами. Тому вони мають порівняно низькі температури плавлення та кипіння. У речовин із немолекулярною структурою хімічний зв'язок між частинками дуже міцний. Тому вони мають високі температури плавлення та кипіння. Сучасна хімія вивчає властивості мікрочастинок (атомів, молекул, іонів та ін.) та макротіл.
Молекули та кристали складаються з атомів. Кожен окремий вид атомів називається хімічним елементом.
Загалом у природі (на Землі) встановлено існування (92) різних хімічних елементів. Ще 22 елементи отримані штучним шляхом із використанням ядерних реакторівта потужних прискорювачів.
Усі речовини поділяються на прості та складні.
Речовини, що складаються з атомів одного елемента, називаються простими.
Сірка S, водень Н 2 , кисень О 2 , озон О 3 фосфор Р, залізо Fe - це прості речовини.
Речовини, що складаються з атомів різних елементів, називаються складними.
Наприклад, вода Н 2 Про складається з атомів різних елементів - водню H і кисню O; крейда CaCO 3 складається з атомів елементів кальцію Ca, вуглецю C і кисню . Вода та крейда – складні речовини.
Поняття "проста речовина" не можна ототожнювати з поняттям "хімічний елемент". Проста речовина характеризується певною щільністю, розчинністю, температурами кипіння та плавлення та ін. Хімічний елемент характеризується певним позитивним зарядом ядра (порядковим номером), ступенем окислення, ізотопним складом та ін. Властивості елемента відносяться до його окремих атомів. Складні речовини складаються з простих речовин, та якщо з елементів. Наприклад, вода складається не з простих речовин водню та кисню, а з елементів водню та кисню.
Назви елементів збігаються з назвами відповідних простих речовин, за винятком вуглецю.
Багато хімічних елементів утворюють кілька простих речовин, різних за будовою та властивостями. Це явище називається алотропією, а речовини, що утворилися алотропними видозмінамиабо модифікаціями. Так, елемент кисень утворює дві алотропні модифікації: кисень та озон; елемент вуглець - три: алмаз, графіт та карбін; Декілька модифікацій утворює елемент фосфор.
Явище алотропии викликається двома причинами: 1) різним числом атомів у молекулі, наприклад кисень Про 2 і озон Про 3 ; 2) утворенням різних кристалічних форм, наприклад алмаз, графіт та карбін.
2. Стехіометричні закони
Стехіометрія- розділ хімії, у якому розглядаються масові та об'ємні відносини між реагуючими речовинами. У перекладі з грецької слово «стехіометрія» має сенс « складова частинаі «вимірюю».
Основу стехіометрії складають стехіометричні закони: збереження маси речовин, сталості складу, закон Авогадро, закон об'ємних відносин газів, закон еквівалентів. Вони підтвердили атомно-молекулярне вчення. У свою чергу атомно-молекулярне вчення пояснює стехіометричні закони.
Подібна інформація.
Уявлення у тому, що це речовини складаються з окремих частинок, виникло задовго до нашої ери. Давньогрецькі філософивважали. Що речовини побудовані з найдрібніших неподільних частинок – атомів, які перебувають у безперервному русі. У проміжках між томами знаходиться пусте місце. Давні мислителі вважали, що всі речовини відрізняються одна від одної формою, числом і розташуванням атомів, що їх утворюють, а всі зміни, що відбуваються в природі, пояснювали з'єднанням або роз'єднанням атомів.
Атомістичні уявлення древніх філософів розвинені М.В. Ломоносовим (1748 р) - струнке атомно-молекулярне вчення, сутність якого зводиться до наступного. Усі речовини складаються з найдрібніших частинок – корпускул (молекул), що у безперервному русі. Корпускули, своєю чергою, складаються з елементів (атомів). Чітко розрізняючи поняття атом і молекула, Ломоносов М.В. набагато випередив закордонних хіміків. Задовго до англійського вченого Дальтона він застосував атомістичні уявлення пояснення низки хімічних і фізичних явищ. Він вважав, що від виду та числа атомів, а також від порядку з'єднання їх між собою залежать властивості речовин, що утворюються. Трохи згодом хіміки визначили поняття хімічного елемента.
Початок 19 століття ознаменувалося відкриттям трьох найважливіших законів: закону сталості складу (Пруст, 1799), закону простих кратних відносин (Дальтон, 1804), закон простих об'ємних відносин для реагуючих газів (Гей-Люссак, 1805). У 1808 р. Дальтон запропонував атомну теорію будови речовини, в хімію вводяться поняття «атом» та «молекула».
Пізніше, ґрунтуючись на атомно-молекулярному вченні, атомних масах та хімічних властивостях елементів, Д.І. Менделєєв у 1869 р. відкрив періодичний закон– один із основних законів природи.
Нині атомно-молекулярне вчення (як і періодичний закон) є основою хімії. Основні положення АМУ полягають у наступному:
1. Усі речовини складаються з хімічно неподільних частинок – атомів.
Атоми являють собою дрібні частинки речовини, які хімічним шляхом неможливо розділити на складові, перетворити їх один на одного або знищити. Атом – система взаємодіючих елементарних частинок, що складається з ядра, утвореного протонами та нейтронами, та електронів.
Атоми різних елементів різняться масою. Сукупність однакових атомів утворює просту речовину, що відповідає певному хімічному елементу. Атоми різних елементів взаємодіють один з одним у цілих відносинах. В результаті виходять складні утворення, зокрема молекули.
2. Молекула – нейтральна за зарядом найменша сукупність атомів, пов'язаних внаслідок хімічної взаємодії у певному порядку (тобто має певну структуру), яка не має, як правило, неспарених електронів і здатна до самостійного існування .
Молекули є найменшими частинками індивідуальної речовини, що зберігають її хімічні властивості, її хімічну індивідуальність. Між молекулами діють сили як тяжіння, і відштовхування. Молекули перебувають у постійному русі (поступальному та обертальному). Молекули хімічно ділимо.
3. Хімічний елемент – це безліч атомів із однаковим зарядом ядра.
4. Речовина – певна сукупність атомних та молекулярних частинок, їх асоціатів та агрегатів, що перебувають у будь-якому з трьох агрегатних станах.
Прості речовини- Це речовини, що складаються з атомів одного і того ж хімічного елемента, а складні речовини утворюються за умови хімічної взаємодії атомів різних хімічних елементів.