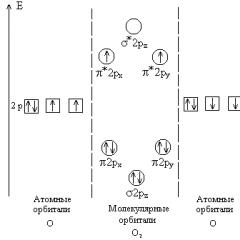
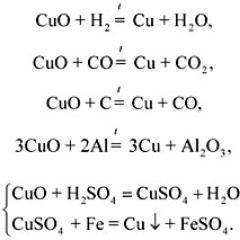Правила складання окисно-відновних реакцій. Правила складання окислювально-відновних реакцій Процеси, що протікають на аноді
Нагадаємо, що на катоді протікають процеси відновлення, на аноді – процеси окислення.
Процеси, що протікають на катоді:
У розчині є кілька видів позитивно заряджених частинок, здатних відновлюватися на катоді:
1) Катіони металу відновлюються до простої речовини, якщо метал знаходиться в ряді напруг правіше алюмінію (не включаючи сам Al). Наприклад:
Zn 2+ +2e → Zn 0 .
2) У разі розчину солі або лугу: катіони водню відновлюються до простої речовини, якщо метал знаходиться в ряді напруг металів до H 2:
2H 2 O + 2e → H 2 0 + 2OH - .
Наприклад, у разі електролізу розчинів NaNO 3 чи KOH.
3) У разі електролізу розчину кислоти: катіони водню відновлюються до простої речовини:
2H + +2e → H 2 .
Наприклад, у разі електролізу розчину H 2 SO 4 .
Процеси, що протікають на аноді:
На аноді легко окислюються кислотні залишки, що не містять кисень. Наприклад, галогенід-іони (крім F -), сульфід-аніони, гідроксид-аніони та молекули води:
1) Галогенід-аніони окислюються до простих речовин:
2Cl - - 2e → Cl 2 .
2) У разі електролізу розчину лугу в гідроксид-аніонах кисень окислюється до простої речовини. Водень вже має ступінь окислення +1 і може бути окислений далі. Також буде виділення води – чому? Тому що більше нічого написати і не вийде: 1) H+ написати не можемо, тому що OH – і H+ не можуть стояти по різні боки одного рівняння; 2) H 2 написати також можемо, оскільки це був процес відновлення водню (2H + +2e → H 2), але в аноді протікають лише процеси окислення.
4OH - - 4e → O 2 + 2H 2 O.
3) Якщо в розчині є аніони фтору або будь-які кисневмісні аніони, то окислення піддаватиметься вода з підкисленням прианодного простору відповідно до наступного рівняння:
2H2O-4e → O2+4H+.
Така реакція йде у разі електролізу розчинів кисневмісних солей або кисневмісних кислот. У разі електролізу розчину лугу окислюватимуться гідроксид-аніони згідно з правилом 2) вище.
4) У разі електролізу розчину солі органічної кислоти на аноді завжди відбувається виділення CO 2 та подвоєння залишку вуглецевого ланцюга:
2R-COO - - 2e → R-R + 2CO 2 .
Приклади:
1. РозчинNaCl
NaCl → Na + + Cl -
Метал Na стоїть у ряді напруги до алюмінію, отже, відновлюватися на катоді не буде (катіони залишаються в розчині). Згідно з правилом вище, на катоді відновлюється водень. Хлорид-аніони будуть окислюватися на аноді до простої речовини:
До: 2Na + (у розчині)
А: 2Cl - - 2e → Cl 2
Коефіцієнт 2 перед Na + з'явився через наявність аналогічного коефіцієнта перед хлорид-іонами, так як у солі NaCl їх співвідношення 1:1.
Перевіряємо, що кількість електронів, що приймаються і віддаються, однакова, і підсумовуємо ліві і праві частини катодних і анодних процесів:
2Na + + 2Cl - + 2H 2 O → H 2 0 + 2Na + + 2OH - + Cl 2 . З'єднуємо катіони та аніони:
2NaCl + 2H 2 O → H 2 0 + 2NaOH + Cl 2 .
2. РозчинNa 2SO 4
Розписуємо дисоціацію на іони:
Na 2 SO 4 → 2Na + + SO 4 2-
Натрій стоїть у ряді напруги до алюмінію, отже, відновлюватися на катоді не буде (катіони залишаються в розчині). Згідно з правилом вище, на катоді відновлюється лише водень. Сульфат-аніони містять кисень, тому окислюватися не будуть, також залишаючись у розчині. Згідно з правилом вище, у цьому випадку окислюються молекули води:
До: 2H 2 O + 2e → H 2 0 + 2OH -
А: 2H2O-4e → O20+4H+.
Зрівнюємо кількість електронів, що приймаються і віддаються на катоді і аноді. Для цього необхідно помножити всі коефіцієнти катодного процесу на 2:
До: 4H 2 O + 4e → 2H 2 0 + 4OH -
А: 2H2O-4e → O20+4H+.
6H 2 O → 2H 2 0 + 4OH - + 4H + + O 2 0 .
4OH- і 4H+ з'єднуємо в 4 молекули H 2 O:
6H 2 O → 2H 2 0 + 4H 2 O + O 2 0 .
Скорочуємо молекули води, що з обох боків рівняння, тобто. віднімаємо з кожної частини рівняння 4H 2 O і отримуємо підсумкове рівняння гідролізу:
2H 2 O → 2H 2 0 + O 2 0 .
Таким чином, гідроліз розчинів кисневмісних солей активних металів (до Al включно) зводиться до гідролізу води, так як ні катіони металів, ні аніони кислотних залишків не беруть участь в окислювально-відновних процесах, що протікають на електродах.
3. РозчинCuCl 2
Розписуємо дисоціацію на іони:
CuCl 2 → Cu 2+ + 2Cl -
Мідь знаходиться в ряді напруг металів після водню, отже, тільки вона відновлюватиметься на катоді. На аноді окислятимуться лише хлорид-аніони.
До:
Cu 2+ + 2e → Cu 0
A: 2Cl - - 2e → Cl 2
CuCl 2 → Cu 0 + Cl 2 .
4. РозчинCuSO 4
Розписуємо дисоціацію на іони:
CuSO 4 → Cu 2+ + SO 4 2-
Мідь знаходиться в ряді напруг металів після водню, отже, тільки вона відновлюватиметься на катоді. На аноді будуть окислюватися молекули води, оскільки кисневмісні кислотні залишки в розчинах на аноді не окислюються.
До: Cu 2+ + 2e → Cu 0
A: SO 4 2- (у розчині)
2H2O-4e → O2+4H+.
Зрівнюємо кількість електронів на катоді та аноді. Для цього помножимо всі коефіцієнти катодного рівняння на 2. Кількість сульфат-іонів також необхідно подвоїти, так як у сульфаті міді співвідношення Cu 2+ і SO 4 2-1:1.
До: 2Cu 2+ + 4e → 2Cu 0
A: 2SO 4 2- (у розчині)
2H2O-4e → O2+4H+.
Записуємо сумарне рівняння:
2Cu 2+ + 2SO 4 2- + 2H 2 O → 2Cu 0 + O 2 + 4H + + 2SO 4 2- .
Поєднавши катіони та аніони, отримуємо підсумкове рівняння електролізу:
2CuSO 4 + 2H 2 O → 2Cu 0 + O 2 + 2H 2 SO 4 .
5. РозчинNiCl 2
Розписуємо дисоціацію на іони:
NiCl 2 → Ni 2+ + 2Cl -
Нікель знаходиться в ряді напруг металів після алюмінію і до водню, отже, на катоді відновлюватимуться і метал, і водень. На аноді окислятимуться лише хлорид-аніони.
До:
Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
A: 2Cl - - 2e → Cl 2
Зрівнюємо кількість електронів, що приймаються та віддаються на катоді та аноді. Для цього множимо всі коефіцієнти анодного рівняння на 2:
До: Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (у розчині)
A: 4Cl - - 4e → 2Cl 2
Помічаємо, що згідно з формулою NiCl 2 співвідношення атомів нікелю і хлору 1:2, отже, в розчин необхідно додати Ni 2+ для отримання загальної кількості 2NiCl 2 . Також це необхідно зробити, тому що в розчині повинні бути протиіони для гідроксид-аніонів.
Складаємо ліві та праві частини катодних та анодних процесів:
Ni 2+ + Ni 2+ + 4Cl - + 2H 2 O → Ni 0 + H 2 0 + 2OH - + Ni 2+ + 2Cl 2 .
З'єднуємо катіони та аніони для отримання підсумкового рівняння електролізу:
2NiCl 2 + 2H 2 O → Ni 0 + H 2 0 + Ni(OH) 2 + 2Cl 2 .
6. РозчинNiSO 4
Розписуємо дисоціацію на іони:
NiSO 4 → Ni 2+ + SO 4 2-
Нікель знаходиться в ряді напруг металів після алюмінію і до водню, отже, на катоді відновлюватимуться і метал, і водень. На аноді будуть окислюватися молекули води, оскільки кисневмісні кислотні залишки в розчинах на аноді не окислюються.
До: Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
A: SO 4 2- (у розчині)
2H2O-4e → O2+4H+.
Перевіряємо, що кількість прийнятих та відданих електронів збігається. Також зауважуємо, що у розчині є гідроксид-іони, але в записі електродних процесів для них немає протиіонів. Отже, потрібно додати розчин Ni 2+ . Так як подвоїлася кількість іонів нікелю, необхідно подвоїти і кількість сульфат-іонів:
До: Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (у розчині)
A: 2SO 4 2- (у розчині)
2H2O-4e → O2+4H+.
Складаємо ліві та праві частини катодних та анодних процесів:
Ni 2+ + Ni 2+ + 2SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + Ni 2+ + 2OH - + H 2 0 + O 2 0 + 2SO 4 2- + 4H + .
З'єднуємо катіони та аніони та записуємо підсумкове рівняння електролізу:
2NiSO 4 + 4H 2 O → Ni 0 + Ni(OH) 2 + H 2 0 + O 2 0 + 2H 2 SO 4 .
В інших джерелах літератури також йдеться про альтернативне протікання електролізу кисневмісних солей металів середньої активності. Різниця полягає в тому, що після складання лівих та правих частин процесів електролізу необхідно з'єднати H+ та OH – з утворенням двох молекул води. 2H +, що залишилися, витрачаються на утворення сірчаної кислоти. У цьому випадку не потрібно додавати додаткові іони нікелю та сульфат-іони:
Ni 2+ + SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + 2OH - + H 2 0 + O 2 0 + SO 4 2- + 4H + .
Ni 2+ + SO 4 2- + 4H 2 O → Ni 0 + H 2 0 + O 2 0 + SO 4 2- + 2H + + 2H 2 O.
Підсумкове рівняння:
NiSO 4 + 2H 2 O → Ni 0 + H 2 0 + O 2 0 + H 2 SO 4 .
7. РозчинCH 3COONa
Розписуємо дисоціацію на іони:
CH 3 COONa → CH 3 COO - + Na +
Натрій стоїть у ряді напруги до алюмінію, отже, відновлюватися на катоді не буде (катіони залишаються в розчині). Згідно з правилом вище, на катоді відновлюється лише водень. На аноді відбувається окислення ацетат-іонів з утворенням вуглекислого газу та подвоєнням залишку вуглецевого ланцюга:
До: 2Na + (у розчині)
2H 2 O + 2e → H 2 0 + 2OH -
А: 2CH 3 COO - - 2e → CH 3 -CH 3 + CO 2
Оскільки кількості електронів у процесах окислення та відновлення збігаються, складаємо сумарне рівняння:
2Na + + 2CH 3 COO - + 2H 2 O → 2Na + + 2OH - + H 2 0 + CH 3 -CH 3 + CO 2
З'єднуємо катіони та аніони:
2CH 3 COONa + 2H 2 O → 2NaOH + H 2 0 + CH 3 -CH 3 + CO 2 .
8. РозчинH 2SO 4
Розписуємо дисоціацію на іони:
H 2 SO 4 → 2H + + SO 4 2-
З катіонів у розчині присутні тільки катіони H+, вони й відновлюватимуться до простої речовини. На аноді протікатиме окислення води, тому що кисень містять кислотні залишки в розчинах на аноді не окислюються.
До:
2H + +2e → H 2
A: 2H 2 O - 4e → O 2 + 4H +
Зрівнюємо кількість електронів. Для цього подвоює кожен коефіцієнт у рівнянні катодного процесу:
До:
4H + +4e → 2H 2
A: 2H 2 O - 4e → O 2 + 4H +
Підсумовуємо ліві та праві частини рівнянь:
4H + + 2H 2 O → 2H 2 + O 2 + 4H +
Катіони H + знаходяться в обох частинах реакції, отже їх потрібно скоротити. Отримуємо, що у разі розчинів кислот електролізу піддаються тільки молекули H 2 O:
2H 2 O → 2H 2 + O 2 .
9. РозчинNaOH
Розписуємо дисоціацію на іони:
NaOH → Na + + OH -
Натрій стоїть у ряді напруги до алюмінію, отже, відновлюватися на катоді не буде (катіони залишаються в розчині). Згідно з правилом, на катоді відновлюється лише водень. На аноді окислюватимуться гідроксид-аніони з утворенням кисню та води:
До: Na+ (у розчині)
2H 2 O + 2e → H 2 0 + 2OH -
А: 4OH - - 4e → O 2 + 2H 2 O
Зрівнюємо кількість електронів, що приймаються та віддаються на електродах:
До: Na + (у розчині)
4H 2 O + 4e → 2H 2 0 + 4OH -
А: 4OH - - 4e → O 2 + 2H 2 O
Підсумовуємо ліві та праві частини процесів:
4H 2 O + 4OH - → 2H 2 0 + 4OH - + O 2 0 + 2H 2 O
Скорочуючи 2H 2 O та іони OH - , отримуємо підсумкове рівняння електролізу:
2H 2 O → 2H 2 + O 2 .
Висновок:
При електролізі розчинів 1) кисневмісних кислот;
2) лугів;
3) солей активних металів і кисневмісних кислот
на електродах протікає електроліз води:
2H 2 O → 2H 2 + O 2 .
Електрод, у якому відбувається відновлення, називається катодом.
Електрод, у якому відбувається окислення, - анодом.
Розглянемо процеси, що відбуваються при електролізі розплавів солей безкисневих кислот: HCl, HBr, HI, H 2 S (за винятком фтороводородної або плавикової - HF).
У розплаві така сіль складається з катіонів металу та аніонів кислотного залишку.
Наприклад, NaCl = Na + + Cl -
На катоді: Na + + ē = Na утворюється металевий натрій (загалом - метал, що входить до складу солі)
На аноді: 2Cl - - 2? = Cl 2 утворюється газоподібний хлор (загалом - галоген, що входить до складу кислотного залишку - крім фтору - або сірка)
Розглянемо процеси, що відбуваються при електроліз розчинів електролітів.
Процеси, що протікають на електродах, визначаються величиною стандартного електродного потенціалу та концентрацією електроліту (Рівняння Нернста). У шкільному курсі не розглядається залежність електродного потенціалу від концентрації електроліту та не використовуються чисельні значення величин стандартного електродного потенціалу. Учням досить знати, що у ряді електрохімічної напруженості металів (ряд активності металів) величина стандартного електродного потенціалу пари Me +n /Me:
- збільшується зліва направо
- метали, що стоять у ряду до водню, мають негативне значення цієї величини
- водень, при відновленні реакції 2Н + + 2? = Н 2 , (тобто з кислот) має нульове значення стандартного електродного потенціалу
- метали, що стоять у ряду після водню, мають позитивне значення цієї величини
! водень при відновленні реакції:
2H 2 O + 2? = 2OH - + H 2 (Тобто з води в нейтральному середовищі) має негативне значення стандартного електродного потенціалу -0,41
Матеріал анода може бути розчинним (залізо, хром, цинк, мідь, срібло та ін. метали) і нерозчинним – інертним – (вугілля, графіт, золото, платина), тому в розчині будуть присутні іони, що утворюються при розчиненні анода:
Ме - nē = Ме +n
Іони металу, що утворилися, будуть присутні в розчині електроліту і їх електрохімічну активність теж буде потрібно враховувати.
Виходячи з цього, для процесів, що протікають на катоді, можна визначити такі правила:
1. катіон електроліту розташований в електрохімічному ряді напруг металів до алюмінію включно, йде процес відновлення води:
2H 2 O + 2? = 2OH - + H 2
Катіони металу залишаються в розчині, в прикатодному просторі
2. катіон електроліту знаходиться між алюмінієм і воднем, залежно від концентрації електроліту йде процес відновлення води або процес відновлення іонів металу. Оскільки концентрація не вказується в завданні, записуються обидва можливі процеси:
2H 2 O + 2? = 2OH - + H 2
Ме +n + nē = Ме
3. катіон електроліту - це іони водню, тобто. електроліт – кислота. Відновлюються іони водню:
2Н + + 2? = Н 2
4. катіон електроліту знаходиться після водню, відновлюються катіони металу.
Ме +n + nē = Ме
Процес на аноді залежить від матеріалу анода та природи аніону.
1. Якщо анод розчиняється (наприклад, залізо, цинк, мідь, срібло), окислюється метал анода.
Ме - nē = Ме +n
2. Якщо анод інертний, тобто. не розчиняється (графіт, золото, платина):
а) При електролізі розчинів солей безкисневих кислот (крім фторидів) йде процес окислення аніону;
2Cl - - 2? = Cl 2
2Br - - 2ē = Br 2
2I - - 2? = I 2
S 2 - - 2? = S
б) При електролізі розчинів лугів, йде процес окислення гідроксогрупи ВІН -:
4OH - - 4? = 2H 2 O + O 2
в) При електролізі розчинів солей кисневмісних кислот: HNO 3 , H 2 SO 4 , H 2 CO 3 , H 3 PO 4 і фторидів, йде процес окислення води.
2H 2 O - 4ē = 4H + + Про 2
г) При електролізі ацетатів (солей оцтової чи етанової кислоти) окислюється ацетат-іон до етану та оксиду вуглецю (IV) - вуглекислого газу.
2СН 3 СОО - - 2? = З 2 Н 6 + 2СО 2
Приклади завдань.
1. Встановіть відповідність між формулою солі та продуктом, що утворюється на інертному аноді при електролізі її водного розчину.
Формула солі
А) NiSO 4
Б) NaClO 4
В) LiCl
Г) RbBr
ПРОДУКТ НА АНОДІ
1) S 2) SO 2 3) Cl 2 4) O 2 5) H 2 6) Br 2
Рішення:
Так як у завданні вказано інертний анод, ми розглядаємо лише зміни, що відбуваються з кислотними залишками, що утворюються при дисоціації солей:
SO 4 2 - кислотний залишок кисневмісної кислоти. Йде процес окиснення води, виділяється кисень. Відповідь 4
ClO 4 - кислотний залишок кисневмісної кислоти. Йде процес окиснення води, виділяється кисень. Відповідь 4.
Cl - кислотний залишок безкисневої кислоти. Йде процес окислення самого кислотного залишку. Виділяється хлор. Відповідь 3.
Br - кислотний залишок безкисневої кислоти. Йде процес окислення самого кислотного залишку. Вирізняється бром. Відповідь 6.
Загальна відповідь: 4436
2. Встановіть відповідність між формулою солі та продуктом, що утворюється на катоді при електролізі її водного розчину.
Формула солі
А) Al(NO 3) 3
Б) Hg(NO 3) 2
В) Cu(NO 3) 2
Г) NaNO 3
ПРОДУКТ НА АНОДІ
1) водень 2) алюміній 3) ртуть 4) мідь 5) кисень 6) натрій
Рішення:
Так як у завданні вказано катод, ми розглядаємо тільки зміни, що відбуваються з катіонами металів, що утворюються при дисоціації солей:
Al 3+ відповідно до положення алюмінію в електрохімічному ряду напруг металів (від початку ряду до алюмінію включно) йтиме процес відновлення води. Виділяється водень. Відповідь 1.
Hg 2+ відповідно до положення ртуті (після водню) йтиме процес відновлення іонів ртуті. Утворюється ртуть. Відповідь 3.
Cu 2+ відповідно до положення міді (після водню) йтиме процес відновлення іонів міді. Відповідь 4.
Na + відповідно до положення натрію (від початку ряду до алюмінію включно) йтиме процес відновлення води. Відповідь 1.
Загальна відповідь: 1341
Електроліз розчинів
та розплавів солей (2 год)
Заняття курсу «Електрохімія»
Цілі першого уроку:
План п о р в о г о р у к а
1. Повторення вивчених способів одержання металів.
2. Пояснення нового матеріалу.
3. Вирішення завдань з підручника Г.Е.Рудзітіса, Ф.Г.Фельдмана «Хімія-9» (М.: Просвітництво, 2002), с. 120 № 1, 2.
4. Перевіряє засвоєння знань на тестових завданнях.
5. Повідомлення про застосування електролізу.
Цілі першого уроку:навчити писати схеми електролізу розчинів та розплавів солей та застосовувати отримані знання для вирішення розрахункових завдань; продовжити формування навичок роботи із підручником, тестовими матеріалами; обговорити застосування електролізу у народному господарстві.
ХІД ПЕРШОГО УРОКУ
Повторення вивчених способів отримання металівз прикладу отримання міді з оксиду міді(II).
Запис рівнянь відповідних реакцій:

Ще один спосіб отримання металів із розчинів та розплавів їх солей – електрохімічний, або електроліз.
Електроліз - це окислювально-відновний процес, що відбувається на електродах при пропусканні електричного струму через розплав або розчин електроліту.
Електроліз розплаву хлориду натрію:
NaCl Na + + Cl -;
катод (–) (Na +): Na + + е= Na 0,
анод (–) (Cl –): Cl – – е= Cl 0, 2Cl 0 = Cl 2;
2NaCl = 2Na + Cl2.
Електроліз розчину хлориду натрію:
NaCl Na + + Cl – ,
H 2 O Н + + ВІН -;
катод (–) (Na + ; Н +): H + + е= H 0 , 2H 0 = H 2
(2H 2 O + 2 е= H 2 + 2OH -),
анод (+) (Cl - ; OН -): Cl - - е= Cl 0, 2Cl 0 = Cl 2;
2NaCl + 2H 2 O = 2NaOH + Cl 2 + H 2 .
Електроліз розчину нітрату міді(II):
Cu(NO 3) 2 Cu 2+ +
Н 2 O H + + OH -;
катод (–) (Cu 2+ ; Н +): Cu 2+ + 2 е= Cu 0
анод (+) (ON –): OH – – е= OH 0 ,
4H 0 = O 2 + 2H 2 O;
2Cu(NO 3) 2 + 2H 2 O = 2Cu + O 2 + 4HNO 3 .
Ці три приклади показують, чому електроліз проводити вигідніше, ніж здійснювати інші способи одержання металів: виходять метали, гідроксиди, кислоти, гази.
Ми писали схеми електролізу, а тепер спробуємо написати відразу рівняння електролізу, не звертаючись до схем, а лише використовуючи шкалу активності іонів:
Приклади рівнянь електролізу:
2HgSO 4 + 2H 2 O = 2Hg + O 2 + 2H 2 SO 4 ;
Na 2 SO 4 + 2H 2 O = Na 2 SO 4 + 2H 2 + O 2;
2LiCl + 2H 2 O = 2LiOH + H 2 + Cl 2 .
Вирішення задачз підручника Г.Е.Рудзітіса та Ф.Г.Фельдмана (9-й клас, с. 120, № 1, 2).
Завдання 1.При електролізі розчину хлориду міді(II) маса катода збільшилася на 8 г. Який газ виділився, яка його маса?
Рішення
CuCl 2 + H 2 O = Cu + Cl 2 + H 2 O,
(Cu) = 8/64 = 0,125 моль,
(Cu) = (Сl 2) = 0,125 моль,
m(Cl 2) = 0,125 71 = 8,875 р.
Відповідь. Газ - хлор масою 8,875 г.
Завдання 2.При електроліз водного розчину нітрату срібла виділилося 5,6 л газу. Скільки грамів металу відклалося на катоді?
Рішення
4AgNO 3 + 2H 2 O = 4Ag + O 2 + 4HNO 3 ,
(O 2) = 5,6/22,4 = 0,25 моль,
(Ag) = 4(O 2) = 4 25 = 1 моль,
m(Ag) = 1107 = 107 р.
Відповідь. 107 г срібла.
Тестування
Варіант 1
1. При електролізі розчину гідроксиду калію на катоді виділяється:
а) водень; б) кисень; в) калій.
2. При електролізі розчину сульфату міді(II) у розчині утворюється:
а) гідроксид міді(II);
б) сірчана кислота;
3. При електролізі розчину хлориду барію на аноді виділяється:
а) водень; б) хлор; в) кисень.
4. При електролізі розплаву хлориду алюмінію на катоді виділяється:
а) алюміній; б) хлор;
в) електроліз неможливий.
5. Електроліз розчину нітрату срібла протікає за такою схемою:
а) AgNO 3 + H 2 O Ag + Н 2 + HNO 3;
б) AgNO 3 + H 2 O Ag + О 2 + HNO 3;
в) AgNO3+H2O AgNO3+Н2+О2.
Варіант 2
1. При електролізі розчину гідроксиду натрію на аноді виділяється:
а) натрій; б) кисень; в) водень.
2. При електролізі розчину сульфіду натрію у розчині утворюється:
а) сірководнева кислота;
б) гідроксид натрію;
3. При електролізі розплаву хлориду ртуті (II) на катоді виділяється:
а) ртуть; б) хлор; в) електроліз неможливий.
4.
5. Електроліз розчину нітрату ртуті (II) протікає за такою схемою:
а) Hg(NO 3) 2 + H 2 O Hg + Н 2 + HNO 3;
б) Hg(NO 3) 2 + H 2 O Hg + О 2 + HNO 3;
в) Hg(NO 3) 2 + H 2 O Hg(NO 3) 2 + Н 2 + О 2 .
Варіант 3
1. При електролізі розчину нітрату міді(II) на катоді виділяється:
а) мідь; б) кисень; в) водень.
2. При електролізі розчину броміду літію у розчині утворюється:
б) бромоводнева кислота;
в) гідроксид літію.
3. При електролізі розплаву хлориду срібла на катоді виділяється:
а) срібло; б) хлор; в) електроліз неможливий.
4. При електролізі розчину хлориду алюмінію виділяється на:
а) катоді; б) аноді; в) залишається у розчині.
5. Електроліз розчину броміду барію протікає за такою схемою:
а) BaBr 2 + H 2 O Br 2 + Н 2 + Ba(OH) 2;
б) BaBr 2 + H 2 O Br 2 + Ba + H 2 O;
в) BaBr 2 + H 2 O Br 2 + О 2 + Ba(OH) 2 .
Варіант 4
1. При електролізі розчину гідроксиду барію на аноді виділяється:
а) водень; б) кисень; в) барій.
2. При електролізі розчину йодиду калію у розчині утворюється:
а) йодоводородна кислота;
б) вода; в) гідроксид калію.
3. При електролізі розплаву хлориду свинцю (II) на катоді виділяється:
а) свинець; б) хлор; в) електроліз неможливий.
4. При електролізі розчину нітрату срібла на катоді виділяється:
а) срібло; б) водень; в) кисень.
5. Електроліз розчину сульфіду натрію протікає за такою схемою:
а) Na 2 S + H 2 O S + Н 2 + NaOH;
б) Na 2 S + H 2 O Н 2 + O 2 + Na 2 S;
в) Na 2 S + H 2 O Н 2 + Na 2 S + NaOH.
Відповіді
| варіант | Питання 1 | Питання 2 | Питання 3 | Питання 4 | Питання 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |
Застосування електролізу у народному господарстві
1. Для захисту металевих виробів від корозії їх поверхню наносять найтонший шар іншого металу: хрому, срібла, золота, нікелю тощо. Іноді, щоб не витрачати дорогі метали, виготовляють багатошарове покриття. Наприклад, зовнішні деталі автомобіля спочатку покривають тонким шаром міді, на мідь наносять тонкий шар нікелю, а на нього шар хрому.
При нанесенні покриттів на метал електролізом вони виходять рівними товщиною, міцними. У такий спосіб можна покривати вироби будь-якої форми. Цю галузь прикладної електрохімії називають гальваностегією.
2. Крім захисту від корозії гальванічні покриття надають гарного декоративного вигляду виробам.
3. Інша галузь електрохімії, близька за принципом гальваностегії, названа гальванопластикою. Це процес отримання точних копій різних предметів. Для цього предмет покривають воском та отримують матрицю. Всі поглиблення копіюваного предмета на матриці будуть опуклостями. Поверхня воскової матриці покривають тонким шаром графіту, роблячи її електричний струм, що проводить.
Отриманий графітовий електрод опускають у ванну із розчином сульфату міді. Анодом служить мідь. При електролізі мідний анод розчиняється, але в графітовому катоді осаджується мідь. Таким чином, виходить точна мідна копія.
За допомогою гальванопластики виготовляють кліше для друку, грамплатівки, металізують різні предмети. Гальванопластика відкрита російським ученим Б. С. Якобі (1838).
Виготовлення штампів для грампластинок включає нанесення найтоншого срібного покриття на пластмасову пластинку, щоб вона стала електропровідною. Потім пластинку наносять електролітичне нікелеве покриття.
Чим слід зробити платівку в електролітичній ванні – анодом чи катодом?
(Відповідь Катодом.)
4. Електроліз використовують для отримання багатьох металів: лужних, лужноземельних, алюмінію, лантаноїдів та ін.
5. Для очищення деяких металів від домішок метал із домішками підключають до анода. Метал розчиняється в процесі електролізу та виділяється на металевому катоді, а домішка залишається в розчині.
6. Електроліз знаходить широке застосування для отримання складних речовин (лугів, кислот, що містять кисень), галогенів.
Практична робота(другий урок)
Цілі уроку.Провести електроліз води, показати гальваностегію практично, закріпити знання, отримані першому уроці.
Устаткування.На столах учнів: плоска батарейка, два дроти з клемами, два графітові електроди, хімічний стакан, пробірки, штатив з двома лапками, 3%-й розчин сульфату натрію, спиртовка, сірники, скіпка.
На столі вчителі: те ж + розчин мідного купоросу, латунний ключ, мідна трубка (шматок міді).
Інструктаж учнів
1. Прикріпити дроти клемами до електродів.
2. Електроди поставити в склянку, щоб вони не торкалися.
3. Налити у склянку розчин електроліту (сульфату натрію).
4. У пробірки налити води і, опустивши в склянку з електролітом догори дном, надіти їх у графітові електроди по черзі, закріпивши верхній край пробірки в лапці штатива.
5. Після того, як прилад буде змонтований, кінці дротів прикріпити до батареї.
6. Спостерігати виділення бульбашок газів: на аноді їх виділяється менше, ніж на катоді. Після того як в одній пробірці майже вся вода витісниться газом, що виділяється, а в іншій - наполовину, від'єднати дроти від батарейки.
7. Запалити спиртування, обережно зняти пробірку, де вода майже повністю витіснилася, і піднести до спиртування - пролунає характерна бавовна газу.
8. Запалити скіпку. Зняти другу пробірку, перевірити тліючою лучиною газ.
Завдання для учнів
1. Замалювати прилад.
2. Написати рівняння електролізу води та пояснити, чому треба було проводити електроліз у розчині сульфату натрію.
3. Написати рівняння реакцій, що відбивають виділення газів на електродах.
Вчительський демонстраційний експеримент
(можуть виконувати найкращі учні класу
за наявності відповідного обладнання)
1. Підключити клеми проводів до мідної трубки та латунного ключа.
2. Опустити трубку та ключ у склянку з розчином сульфату міді(II).
3. Підключити другі кінці проводів до батареї: мінус батареї до мідної трубки, плюс до ключа!
4. Спостерігати виділення міді на поверхні ключа.
5. Після виконання експерименту спочатку від'єднати клеми від батарейки, потім вийняти ключ із розчину.
6. Розібрати схему електролізу з розчинним електродом:
CuSО 4 = Сu 2+ +
анод (+): Сu 0 - 2 e= Cu 2+ ,
катод (–): Cu 2+ + 2 e= Сu 0.
Сумарне рівняння електролізу з розчинним анодом не можна написати.
Електроліз проводився в розчині сульфату міді(II), оскільки:
а) необхідний розчин електроліту, щоб протікав електричний струм, т.к. вода є слабким електролітом;
б) не виділятимуться будь-які побічні продукти реакцій, а лише мідь на катоді.
7. Для закріплення пройденого написати схему електролізу хлориду цинку з вугільними електродами:
ZnCl 2 = Zn 2+ + 2Cl – ,
катод (–): Zn 2+ + 2 e= Zn 0
2H 2 O + 2 e= H 2 + 2OH – ,
анод (+): 2Cl – – 2 e= Cl2.
Сумарне рівняння реакції у разі написати не можна, т.к. невідомо, яка частина загальної кількості електрики йде відновлення води, а яка – відновлення іонів цинку.
 |
Схема демонстраційного експерименту |
Домашнє завдання
1. Написати рівняння електролізу розчину, що містить суміш нітрату міді(II) та нітрату срібла, з інертними електродами.
2. Написати рівняння електролізу розчину гідроксиду натрію.
3. Щоб очистити мідну монету, її треба підвісити на мідному дроті, приєднаному до негативного полюса батареї, і опустити в 2,5% розчин NаОН, куди слід завантажити також графітовий електрод, приєднаний до позитивного полюса батареї. Поясніть, як монета стає чистою. ( Відповідь. На катоді йде відновлення іонів водню:
2Н + + 2 е= Н2.
Водень вступає в реакцію з оксидом міді, що знаходиться на поверхні монети:
СuО + Н2 = Сu + Н2О.
Цей метод краще, ніж чищення порошком, т.к. не стирається монета.)