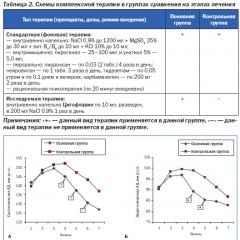
सहसंयोजक बंधन के गुण। सल्फर की संयोजकता क्या है? सल्फर की संभावित संयोजकता
टेस्ट 4
थीम "सहसंयोजक बंधन"
विकल्प 1
1. सहसंयोजक बंधों के संयोजन में एक रासायनिक तत्व के परमाणु की संयोजकता बराबर होती है a) इस परमाणु में इलेक्ट्रॉनों की संख्या b) इस परमाणु द्वारा निर्मित इलेक्ट्रॉनों के सामान्य जोड़े की संख्या c) इसके नाभिक का आवेश परमाणु डी) उस अवधि की संख्या जिसमें यह तत्व स्थित है
2. कार्बन डाइऑक्साइड अणु CO2 का सूत्र कहलाता है
a) आणविक सूत्र b) ग्राफिक सूत्र c) इलेक्ट्रॉनिक सूत्र d) भौतिक सूत्र
3. बाहरी इलेक्ट्रॉन परत के पूरा होने से पहले क्लोरीन परमाणु से कितने इलेक्ट्रॉन गायब हैं?
ए) 1 बी) 2 सी) 3 डी) 7
4. एक कार्बन परमाणु ने दो ऑक्सीजन परमाणुओं को जोड़ा है, इस प्रकार इलेक्ट्रॉनों के चार सामान्य जोड़े बनते हैं। इस यौगिक में कार्बन की संयोजकता बताइए।
ए) मैं बी) द्वितीय सी) III डी) IV
5. ब्रोमीन अणु में रासायनिक बंधन Br 2
a) आयनिक b) धात्विक
सी) सहसंयोजक गैर-ध्रुवीय डी) सहसंयोजक ध्रुवीय
6. बीच अलकाली धातुएक हलोजन के लिए एक परमाणु की इलेक्ट्रोनगेटिविटी आमतौर पर होती है
ए) नहीं बदलता है
सी) घट जाती है
घ) बढ़ता है
ए) बेरिलियम बी) सोडियम
सी) मैग्नीशियम डी) लिथियम
8. तत्वों की एक श्रृंखला में, तत्वों की इलेक्ट्रोनगेटिविटी उसी तरह बदलती (बढ़ती या घटती) है जैसे कि
ए) उन्हें धात्विक गुण
बी) उनके परमाणुओं की त्रिज्या
सी) उनके गैर-धातु गुण
डी) प्रति इलेक्ट्रॉनों की संख्या बाहरी स्तरपरमाणुओं
9. NO अणु में क्रमशः नाइट्रोजन और ऑक्सीजन परमाणुओं का आंशिक आवेश क्या है?
ए) एन 2 बी) एनएच 3 सी) एच 2 डी) सीएल 2
विकल्प 2
1. एक सहसंयोजक बंधन एक रासायनिक बंधन है क्योंकि a) इलेक्ट्रॉनों के सामान्य जोड़े का निर्माण
बी) इलेक्ट्रॉनों के अकेले जोड़े का गठन
c) विपरीत आवेश वाले आयनों का आकर्षण
डी)) धातु आयनों और मुक्त इलेक्ट्रॉनों के बीच बातचीत
2. हाइड्रोजन सल्फाइड अणु का इलेक्ट्रॉनिक सूत्र क्या है?
ए) एच 2 एस बी) एच - एस - एच
सी) एच : : एस : : एच डी) एच : एस : एच
3. बाहरी इलेक्ट्रॉन परत के पूरा होने से पहले फॉस्फोरस परमाणु से कितने इलेक्ट्रॉन गायब हैं?
ए) 5 बी) 2 सी) 3 डी) 4
4. सल्फर परमाणु ने तीन ऑक्सीजन परमाणुओं को जोड़ा, इस प्रकार इलेक्ट्रॉनों के छह सामान्य जोड़े बनते हैं। इस यौगिक में सल्फर की संयोजकता बताइए।
ए) II बी) VI सी) IV डी) III
5. एक सहसंयोजक गैर-ध्रुवीय बंधन वाले पदार्थ का सूत्र
ए) एसओ 2 बी) बीआर 2 सी) एच 2 ओ डी) NaCl
6. एक समूह में, मुख्य उपसमूह में, ऊपर से नीचे तक, एक परमाणु की इलेक्ट्रोनगेटिविटी, एक नियम के रूप में,
ए) नहीं बदलता है
बी) पहले बढ़ता है, फिर घटता है
सी) घट जाती है
घ) बढ़ता है
7. बीच सूचीबद्ध तत्वकम से कम विद्युत ऋणात्मक तत्व चुनें
ए) फ्लोरीन बी) ऑक्सीजन
सी) सल्फर डी) क्लोरीन
8. अणु में क्रमशः बोरॉन और फ्लोरीन परमाणुओं का आंशिक आवेश क्या है?
ए) सकारात्मक और नकारात्मक
बी) नकारात्मक और नकारात्मक
ग) सकारात्मक और सकारात्मक
डी) नकारात्मक और सकारात्मक
9. एक ध्रुवीय सहसंयोजक बंधन युक्त अणु चुनें
ए) एनएच 3 बी) एचसीएल सी) एफ 2 डी) एसओ 3
10. अमोनिया अणु NH3 में रासायनिक बंधन
ए) आयनिक
बी) धातु
सी) सहसंयोजक गैर-ध्रुवीय
डी) सहसंयोजक ध्रुवीय
विकल्प 3 1. एक नियम के रूप में, एक सहसंयोजक बंधन किसके बीच बनता है:
a) एक विशिष्ट धातु के परमाणु और एक विशिष्ट अधातु के परमाणु
बी) धातु परमाणु
ग) विशिष्ट धातु परमाणु और अक्रिय गैस परमाणु
d) अधातुओं के परमाणु
2. क्लोरीन अणु Cl . का सूत्र : सीएल कहा जाता है
ए) आणविक सूत्र
बी) ग्राफिक फॉर्मूला
ग) इलेक्ट्रॉनिक सूत्र
डी) भौतिक सूत्र
3. बाहरी इलेक्ट्रॉन परत के पूरा होने से पहले ऑक्सीजन परमाणु से कितने इलेक्ट्रॉन गायब हैं?
ए) 1 बी) 2 सी) 3 डी) 6
4. किसी रासायनिक तत्व के परमाणु द्वारा बनने वाले सहसंयोजक बंधों की संख्या है
ए) इस परमाणु द्वारा गठित इलेक्ट्रॉनों के सामान्य जोड़े की संख्या
सी) परमाणु के बाहरी स्तर पर युग्मित इलेक्ट्रॉनों की संख्या
d) किसी दिए गए परमाणु से जुड़े अन्य परमाणुओं की संख्या
5. समूह में, मुख्य उपसमूह में, ऊपर से नीचे तक, परमाणु की त्रिज्या, एक नियम के रूप में
6. सूचीबद्ध तत्वों में से उस तत्व का चयन कीजिए जिसके परमाणु की त्रिज्या सबसे अधिक है
ए) बोरॉन बी) सिलिकॉन सी) एल्यूमीनियम डी) कार्बन
7. एक सहसंयोजक गैर-ध्रुवीय बंधन के मामले में, इलेक्ट्रॉनों की एक सामान्य जोड़ी
घ) लापता
8. SO2 अणु में क्रमशः ऑक्सीजन और सल्फर परमाणुओं का आंशिक आवेश क्या है?
बी) नकारात्मक और नकारात्मक
9. एक गैर-ध्रुवीय सहसंयोजक बंधन वाले अणु का चयन करें:
ए) एनएच 3 बी) एच 2 ओ सी) नंबर 2 डी) एच 2
10. लेड सल्फाइड PbS अणु में रासायनिक बंधन
ए) सहसंयोजक गैर-ध्रुवीय बी) सहसंयोजक ध्रुवीय
सी) आयनिक डी) धातु
विकल्प 4
1. एक अणु में दो हाइड्रोजन परमाणुओं को धारण करने वाले बलों की प्रकृति क्या है?
ए) रासायनिक बी) भौतिक
सी) इलेक्ट्रिक डी) परमाणु
2. जल के अणु H - O - H के सूत्र को कहते हैं
ए) आणविक सूत्र
बी) ग्राफिक फॉर्मूला
ग) इलेक्ट्रॉनिक सूत्र
डी) भौतिक सूत्र
3. बाहरी इलेक्ट्रॉन परत के पूरा होने से पहले सिलिकॉन परमाणु से कितने इलेक्ट्रॉन गायब हैं?
1) 1 बी) 2 सी) 3 डी) 4
4. एक बोरॉन परमाणु में अयुग्मित इलेक्ट्रॉनों की संख्या होती है
1) 1 बी) 2 सी) 3 डी) 4
5. किसी रासायनिक तत्व के परमाणु द्वारा बनने वाले उभयनिष्ठ युग्मों की संख्या है:
एक) कुल गणनाएक परमाणु में इलेक्ट्रॉन
बी) परमाणु के बाहरी स्तर पर इलेक्ट्रॉनों की संख्या
c) परमाणु के बाहरी स्तर पर अयुग्मित इलेक्ट्रॉनों की संख्या
डी) परमाणु के बाहरी स्तर पर युग्मित इलेक्ट्रॉनों की संख्या
6. क्षार धातु से हैलोजन की अवधि में, परमाणु की त्रिज्या, एक नियम के रूप में,
ए) बढ़ रहा है बी) घट रहा है
c) नहीं बदलता है d) पहले बढ़ता है, फिर घटता है
7. सूचीबद्ध तत्वों में से उस तत्व का चयन कीजिए जिसके परमाणु की त्रिज्या सबसे छोटी है:
1) कार्बन बी) फास्फोरस सी) सिलिकॉन डी) नाइट्रोजन
8. सहसंयोजक ध्रुवीय बंधन के मामले में, इलेक्ट्रॉनों की एक सामान्य जोड़ी
ए) एक अधिक विद्युतीय परमाणु की ओर स्थानांतरित हो गया
b) परमाणुओं के नाभिक से समान दूरी पर है
c) पूरी तरह से परमाणुओं में से एक के स्वामित्व में
घ) लापता
9. अमोनिया अणु NH3 में क्रमशः हाइड्रोजन और नाइट्रोजन परमाणुओं का आंशिक आवेश कितना है?
ए) सकारात्मक और सकारात्मक
बी) नकारात्मक और नकारात्मक
सी) सकारात्मक और नकारात्मक
घ) नकारात्मक और सकारात्मक?
10. एक ध्रुवीय सहसंयोजक बंधन युक्त अणु चुनें
ए) एच 2 ओ बी) एच 2 सी) ओ 2 डी) एफ 2
कोडिफायर
विकल्प
№ प्रश्न
1
2
3
4
भाग क. बहुविकल्पी परीक्षण
1. परमाणु +17 के नाभिक के आवेश में एक रासायनिक तत्व के परमाणु होते हैं:
2. हाइड्रोजन अणु में सामान्य इलेक्ट्रॉन जोड़े की संख्या:
3. सहसंयोजक नहीं ध्रुवीय बंधनएक पदार्थ के अणु में मौजूद होता है जिसका सूत्र है:
4. कई पदार्थों में फॉस्फोरस की ऑक्सीकरण अवस्था, जिसके सूत्र Ca3P2-P-P2O3-P2O5 हैं:

5. आवधिक प्रणाली के समूह वी के मुख्य उपसमूह के तत्व ई के हाइड्रोजन यौगिक का संरचनात्मक सूत्र:

6. रासायनिक प्रतिक्रिया का समीकरण 2SO2 + O2 = 2SO3 सल्फर रूपांतरण योजना से मेल खाता है:

7. परिवर्तन की श्रृंखला में पदार्थ X N2 → NH3 → X → NO2 का सूत्र है:
8. कार्बोनेट आयन के लिए अभिकारक धनायन है:
9. रासायनिक प्रतिक्रियाउन पदार्थों के बीच संभव है जिनके सूत्र हैं:
10. पदार्थों के परस्पर क्रिया के दौरान सल्फर ऑक्साइड (IV) नहीं बनता है, जिसके सूत्र हैं:
भाग ख. नि:शुल्क उत्तर के साथ सत्रीय कार्य
11. प्रतिक्रिया समीकरण लिखिए जिसके साथ आप योजना के अनुसार परिवर्तन कर सकते हैं:

12. ओवीआर के दृष्टिकोण से कार्य 11 से परिवर्तन 2 पर विचार करें।

13. टास्क 11 में से आयन एक्सचेंज रिएक्शन को चुनें और इसे आयन के रूप में लिखें।

14. अमोनिया के द्रव्यमान (किलो में) की गणना करें, जो हाइड्रोजन की अधिकता के साथ 2 किमी नाइट्रोजन की प्रतिक्रिया से प्राप्त होता है।

15. नाम रासायनिक तत्व, जो यौगिकों में कभी भी सकारात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करता है।
विकल्प 1।
1. एक परमाणु +8 के नाभिक के आवेश में एक रासायनिक तत्व के परमाणु होते हैं:
बी ऑक्सीजन।
2. क्लोरीन अणु में सामान्य इलेक्ट्रॉन जोड़े की संख्या:
तीन बजे।
3. किसी पदार्थ के अणु में सहसंयोजी ध्रुवीय आबंध होता है जिसका सूत्र है:
बी सीओ 2।
4. कई पदार्थों में नाइट्रोजन ऑक्सीकरण की डिग्री, जिसके सूत्र N2-NO-NO2-HNO3 हैं:
A. 0 से बढ़कर +5 हो जाता है।
5. आवधिक प्रणाली के समूह VI के मुख्य उपसमूह के तत्व ई के हाइड्रोजन यौगिक का संरचनात्मक सूत्र:
वी. एन-ई-एन.
6. रासायनिक प्रतिक्रिया का समीकरण H2S + C12 = 2HC1 + S क्लोरीन रूपांतरण योजना से मेल खाता है:
A.Cl0→Cl-1
7. परिवर्तन की श्रृंखला में पदार्थ X С02→ X→Са(НСО3)2→ CO2 का सूत्र है:
बी CaCO3।
8. क्लोराइड आयन के लिए अभिकर्मक धनायन है:
बी एजी +।
D. H2SO4 और MgO।
10. नाइट्रिक ऑक्साइड (IV) पदार्थों के परस्पर क्रिया से बनता है, जिसके सूत्र हैं:
बी एचएनओ 3 (सांद्र) और एजी।
2P + 3Zn = Zn3P2
Zn3P2 + 3H2O + 4O2 = 3Zn(OH)2 + P2O5
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 6Na = 2Na3PO4 + 3H2
Na3PO4 + 3AgNO3 = Ag3PO4↓+ 3NaNO3
Zn3P2-3 + 3H2O + 4O20 = 3Zn(OH)2 + P2+5O5-2
O2 0 → 2O -2 +2 ई, ऑक्सीडाइज़र
पी -3 → पी +5 - 8 ई, कम करने वाला एजेंट
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + PO4 3-+ 3Ag+ + 3NO3- = Ag3PO4↓+ 3Na+ + 3NO3-
PO4 3-+ 3Ag+= Ag3PO4↓
14. हाइड्रोजन क्लोराइड के द्रव्यमान (किलो में) की गणना करें, जो हाइड्रोजन की अधिकता के साथ 4.48 m3 क्लोरीन की प्रतिक्रिया से प्राप्त होता है।
n(Cl2) = 4480dm3 / 22.4 dm3 / mol = 200mol
n (HCl) = 2n (Cl2) = 400 mol
मी (एचसीएल) \u003d 400 मोल * 36.5 ग्राम / मोल \u003d 14600 ग्राम \u003d 14.6 किग्रा
15. उस रासायनिक तत्व का नाम बताइए जिसके नाभिक में एक समस्थानिक होता है जिसमें न्यूट्रॉन नहीं होते हैं।
हाइड्रोजन
विकल्प 2।
भाग क. बहुविकल्पी परीक्षण
1. परमाणु +17 के नाभिक के आवेश में एक रासायनिक तत्व के परमाणु होते हैं:
जी क्लोरीन।
2. हाइड्रोजन अणु में सामान्य इलेक्ट्रॉन जोड़े की संख्या:
ए. 1.
3. किसी पदार्थ के अणु में एक सहसंयोजी अध्रुवीय आबंध होता है, जिसका सूत्र है:
ए. एन2.
4. कई पदार्थों में फॉस्फोरस की ऑक्सीकरण अवस्था, जिसके सूत्र Ca3P2-P-P2O3-P2O5 हैं:
B. -3 से बढ़कर +5 हो जाता है।
5. आवधिक प्रणाली के समूह वी के मुख्य उपसमूह के तत्व ई के हाइड्रोजन यौगिक का संरचनात्मक सूत्र:
जी. एन-ई-एन.
एच
6. रासायनिक प्रतिक्रिया का समीकरण 2SO2 + O2 = 2SO3 सल्फर रूपांतरण योजना से मेल खाता है:
बी एस+4 → एस+6।
7. परिवर्तन की श्रृंखला में पदार्थ X N2 → NH3 → X → NO2 का सूत्र है:
बी नहीं।
8. कार्बोनेट आयन के लिए अभिकारक धनायन है:
ए एच +।
9. उन पदार्थों के बीच रासायनिक प्रतिक्रिया संभव है जिनके सूत्र हैं:
B. P2O5 और NaOH।
10. पदार्थों के परस्पर क्रिया के दौरान सल्फर ऑक्साइड (IV) नहीं बनता है, जिसके सूत्र हैं:
D. CaCO3 और H2SO4।
भाग ख. नि:शुल्क उत्तर के साथ सत्रीय कार्य
1. एमजी + एस = एमजीएस
2. 2 MgS + 3O2 = 2MgO + 2SO2,
3. 2SO2 + O2 = 2SO3
4. SO3 + Na2O = Na2SO4
5. Na2SO4 + BaCl2 = BaSO4 + 2NaCl
12. ओवीआर के दृष्टिकोण से कार्य 11 से परिवर्तन 2 पर विचार करें।
2 MgS-2 + ZO20 = 2MgO-2 + 2S + 4O2-2,
S-2 → S+4 , -6e, अपचायक एजेंट
O20 → 2O-2 + 2 * 2e, ऑक्सीकरण एजेंट
13. टास्क 11 में से आयन एक्सचेंज रिएक्शन को चुनें और इसे आयन के रूप में लिखें।
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
SO42- + Ba2+ = BaSO4
14. अमोनिया के द्रव्यमान (किलो में) की गणना करें, जो हाइड्रोजन की अधिकता के साथ 2 किमी नाइट्रोजन की प्रतिक्रिया से प्राप्त होता है।
N2 + 3H2 = 2NH3
n(NH3) = 2n(N2) = 4kmol = 4000 mol
मी(NH3) \u003d 4000 mol * 17 g / mol \u003d 68000 g \u003d 68 किग्रा।
15. एक रासायनिक तत्व का नाम बताइए जो यौगिकों में कभी भी सकारात्मक ऑक्सीकरण अवस्था नहीं दिखाता है।
एक अधातु तत्त्व
विकल्प 3.
भाग क. बहुविकल्पी परीक्षण
1. एक परमाणु +14 के नाभिक के आवेश में एक रासायनिक तत्व के परमाणु होते हैं:
वी. सिलिकॉन.
2. ब्रोमीन अणु में सामान्य इलेक्ट्रॉन जोड़े की संख्या:
ए. 1.
3. एक पदार्थ में एक सहसंयोजी ध्रुवीय बंधन मौजूद होता है जिसका सूत्र है:
बी एच2एस.
4. कई पदार्थों में सल्फर के ऑक्सीकरण की डिग्री, जिसके सूत्र SO3-SO2-S-H2S हैं:
D. +6 से -2 तक घट जाता है।
5. आवधिक प्रणाली के समूह VII के मुख्य उपसमूह के तत्व ई के हाइड्रोजन यौगिक का संरचनात्मक सूत्र:
ए. एन-ई.
6. रासायनिक प्रतिक्रिया समीकरण 4NH3 + 5O2 = 4NO + 6H2O नाइट्रोजन रूपांतरण योजना से मेल खाती है:
बी एन -3 → एन + 2।
7. परिवर्तन की श्रृंखला में पदार्थ X PH3 → P2O5 → X → Ca3 (PO4) 2 का सूत्र है:
ए. एच3पीओ4.
8. सल्फेट आयन के लिए अभिकर्मक धनायन है:
बी बीए2+।
9. उन पदार्थों के बीच रासायनिक प्रतिक्रिया संभव है जिनके सूत्र हैं:
ए CO2 और NaOH।
10. कार्बन मोनोऑक्साइड (IV) पदार्थों के परस्पर क्रिया से बनता है, जिसके सूत्र हैं:
B. CaCO3 और HC1.
भाग ख. नि:शुल्क उत्तर के साथ सत्रीय कार्य
11. प्रतिक्रिया समीकरण लिखिए जिसके साथ आप योजना के अनुसार परिवर्तन कर सकते हैं:
SiH4 → SiO2 → Na2SiO3 → H2SiO3 →SiO2 → Si।
1. SiH4 + 2O2 = SiO2 + 2H2O
2. SiO2 + Na2O = Na2SiO3
3. Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
4. H2SiO3 = SiO2 + H2O
5. SiO2+2C ---> Si + 2CO
12. ओवीआर के दृष्टिकोण से कार्य 11 से परिवर्तन 5 पर विचार करें।
Si+4O2+2C0 ---> Si0 + 2C+2O
Si+4 →Si0 +4е, ऑक्सीडाइज़र
C0 →C+2 -2e, कम करने वाला एजेंट
13. टास्क 11 में से आयन एक्सचेंज रिएक्शन को चुनें और इसे आयन के रूप में लिखें।
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
SiO32- + 2H+ = H2SiO3↓
14. अमोनियम क्लोराइड के द्रव्यमान (किलो में) की गणना करें, जो अमोनिया की अधिकता के साथ हाइड्रोजन क्लोराइड के 11.2 m3 की परस्पर क्रिया से बनता है।
एचसीएल + NH3 = NH4Cl
n(HCl) = n(NH4Cl) = 11200 dm3/22.4 dm3/mol = 500 mol
मी(NH4Cl) \u003d 500 mol * 56.5 g / mol \u003d 28250 g \u003d 28.250 किग्रा।
15. अधातु गुणों को बढ़ाने के क्रम में रासायनिक तत्वों फास्फोरस, ऑक्सीजन, सल्फर, क्लोरीन को व्यवस्थित करें।
फास्फोरस, सल्फर, ऑक्सीजन, क्लोरीन
विकल्प 4.
भाग क. बहुविकल्पी परीक्षण
1. परमाणु +16 के नाभिक के आवेश में एक रासायनिक तत्व के परमाणु होते हैं:
वी. सल्फर।
2. नाइट्रोजन अणु में सामान्य इलेक्ट्रॉन जोड़े की संख्या:
तीन बजे।
3. किसी पदार्थ में सहसंयोजी अध्रुवीय आबंध होता है जिसका सूत्र है:
बी ओ 2।
4. कई पदार्थों में कार्बन के ऑक्सीकरण की डिग्री, जिसके सूत्र CH4-C-CO-CO2 हैं:
B. -4 से बढ़कर +4 हो जाता है।
5. आवधिक प्रणाली के समूह IV के मुख्य उपसमूह के तत्व ई के हाइड्रोजन यौगिक का संरचनात्मक सूत्र:
डब्ल्यू एन-ई-एन
6. रासायनिक प्रतिक्रिया समीकरण Cu + 4HNO3 = CU(NO3)2 + 2NO2 + 2H2O नाइट्रोजन रूपांतरण योजना से मेल खाती है:
डी. एन+5 →एन+4.
7. परिवर्तन की श्रृंखला में पदार्थ X S → S02 → X → Na2SO3 का सूत्र है:
D. H2SO3.
8. फॉस्फेट आयन के लिए अभिकारक धनायन है:
डी एजी +।
9. उन पदार्थों के बीच रासायनिक प्रतिक्रिया संभव है जिनके सूत्र हैं:
बी सीओ 2 और सीए (ओएच) 2।
10. सिलिकिक अम्ल पदार्थों के परस्पर क्रिया से बनता है, जिसके सूत्र हैं:
बी Na2SiO3 और HC1।
भाग ख. नि:शुल्क उत्तर के साथ सत्रीय कार्य
11. प्रतिक्रिया समीकरण लिखिए जिसके साथ आप योजना के अनुसार परिवर्तन कर सकते हैं:
N2 →NH3 →NO→NO2→ HNO3→ KNO3।
1. N2 + 3H2 = 2NH3
2. 4NH3 + 5O2 = 4NO + 6H2O
3. 2NO + O2 = 2NO2
4. 4NO2 + O2 + 2H2O → 4HNO3
5. HNO3 + KOH = KNO3 + H2O
12. ओवीआर के दृष्टिकोण से कार्य 11 में परिवर्तन 2 पर विचार करें।
4N-3H3 + 5O20 = 4N+2O-2 + 6H2O
N-3 ->N+2, -5e, कम करने वाला एजेंट
O20-> 2O-2 ,+ 2*2e, ऑक्सीडाइज़र
13. टास्क 11 में से आयन एक्सचेंज रिएक्शन को चुनें और इसे आयन के रूप में लिखें।
HNO3 + KOH = KNO3 + H2O
एच+ + ओएच- = एच2ओ
14. अतिरिक्त ऑक्सीजन में हाइड्रोजन सल्फाइड के 4.48 m3 के दहन के दौरान बनने वाले सल्फर ऑक्साइड (IV) के द्रव्यमान (किलो में) की गणना करें।
2H2S + 3O2 = 2SO2 + 2H2O
n(H2S) = n(SO2) = 44800 dm3/22.4 dm3/mol = 2000 mol
m(SO2) = 2000 mol * 64 g/mol = 128000 g = 128 kg
15. सबसे आम रासायनिक तत्व क्या है:
A. पृथ्वी की पपड़ी में:
ऑक्सीजन
बी ब्रह्मांड में:
हाइड्रोजन