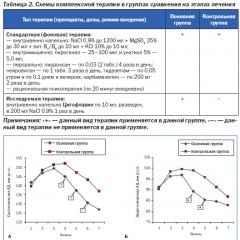
संरचनात्मक आइसोमर्स के उदाहरण। आइसोमरों
लेख की सामग्री
संवयविता(जीआर। isos - वही, meros - part) रसायन विज्ञान में सबसे महत्वपूर्ण अवधारणाओं में से एक है, मुख्यतः कार्बनिक में। पदार्थों में एक ही संरचना और आणविक भार हो सकते हैं, लेकिन विभिन्न संरचनाएं और यौगिक जिनमें समान तत्व समान मात्रा में होते हैं, लेकिन परमाणुओं या परमाणुओं के समूहों की स्थानिक व्यवस्था में भिन्न होते हैं, आइसोमर कहलाते हैं। आइसोमेरिज्म एक कारण है कि कार्बनिक यौगिक इतने असंख्य और विविध हैं।
आइसोमेरिज्म की खोज सबसे पहले जे. लिबिग ने 1823 में की थी, जिन्होंने पाया कि फुलमिनेंट और आइसोसायनिक एसिड के सिल्वर सॉल्ट: Ag-O-N=C और Ag-N=C=O की संरचना समान है, लेकिन विभिन्न गुण. शब्द "आइसोमेरिज्म" को 1830 में आई. बर्जेलियस द्वारा पेश किया गया था, जिन्होंने सुझाव दिया था कि एक ही संरचना के यौगिकों के गुणों में अंतर इस तथ्य के कारण उत्पन्न होता है कि अणु में परमाणुओं को एक असमान क्रम में व्यवस्थित किया जाता है। एएम बटलरोव के सिद्धांत के निर्माण के बाद आखिरकार आइसोमेरिज्म के बारे में विचार बने रासायनिक संरचना(1860)। इस सिद्धांत के प्रावधानों के आधार पर, उन्होंने सुझाव दिया कि चार अलग-अलग ब्यूटेनॉल होने चाहिए (चित्र 1)। जब तक सिद्धांत बनाया गया था, तब तक पौधों की सामग्री से प्राप्त केवल एक ब्यूटेनॉल (सीएच 3) 2 सीएचसीएच 2 ओएच ज्ञात था।
चावल। 1. ब्यूटेनॉल के समावयवी
बुटानॉल के सभी आइसोमर्स के बाद के संश्लेषण और उनके गुणों का निर्धारण सिद्धांत की एक ठोस पुष्टि बन गया।
आधुनिक परिभाषा के अनुसार, एक ही संरचना के दो यौगिकों को आइसोमर माना जाता है यदि उनके अणुओं को अंतरिक्ष में नहीं जोड़ा जा सकता है ताकि वे पूरी तरह से मेल खाते हों। संयोजन, एक नियम के रूप में, मानसिक रूप से किया जाता है, जटिल मामलों में, स्थानिक मॉडल या गणना विधियों का उपयोग किया जाता है।
समरूपता के कई कारण हैं।
स्ट्रक्चरल आइसोमेरिज्म
यह, एक नियम के रूप में, हाइड्रोकार्बन कंकाल की संरचना में अंतर या कार्यात्मक समूहों या कई बांडों की असमान व्यवस्था के कारण होता है।
हाइड्रोकार्बन कंकाल का समरूपता।
एक से तीन कार्बन परमाणुओं (मीथेन, ईथेन, प्रोपेन) से युक्त संतृप्त हाइड्रोकार्बन में आइसोमर्स नहीं होते हैं। चार कार्बन परमाणुओं सी 4 एच 10 (ब्यूटेन) के साथ एक यौगिक के लिए, दो आइसोमर संभव हैं, पेंटेन सी 5 एच 12 के लिए - तीन आइसोमर्स, हेक्सेन सी 6 एच 14 - पांच (छवि 2) के लिए:
चावल। 2. सरलतम हाइड्रोकार्बन के समावयवी
हाइड्रोकार्बन अणु में कार्बन परमाणुओं की संख्या में वृद्धि के साथ, संभावित आइसोमर्स की संख्या नाटकीय रूप से बढ़ जाती है। हेप्टेन सी 7 एच 16 के लिए, नौ आइसोमर हैं, हाइड्रोकार्बन सी 14 एच 30 - 1885 आइसोमर्स के लिए, हाइड्रोकार्बन सी 20 एच 42 के लिए - 366,000 से अधिक।
जटिल मामलों में, यह सवाल कि क्या दो यौगिक आइसोमर्स हैं, वैलेंस बॉन्ड के चारों ओर विभिन्न घुमावों का उपयोग करके तय किया जाता है (सरल बॉन्ड इसकी अनुमति देते हैं, जो कुछ हद तक उनके भौतिक गुणों से मेल खाते हैं)। अणु के अलग-अलग टुकड़ों की गति के बाद (बंधों को तोड़े बिना), एक अणु दूसरे पर आरोपित होता है (चित्र 3)। यदि दो अणु बिल्कुल समान हैं, तो ये समावयवी नहीं हैं, बल्कि एक ही यौगिक हैं:
कंकाल संरचना में भिन्न आइसोमर्स आमतौर पर भिन्न होते हैं भौतिक गुण(गलनांक, क्वथनांक, आदि), जो आपको एक को दूसरे से अलग करने की अनुमति देता है। इस प्रकार का आइसोमेरिज्म सुगंधित हाइड्रोकार्बन में भी मौजूद होता है (चित्र 4):
चावल। 4. सुगंधित आइसोमर्स
स्थिति समरूपता।
एक अन्य प्रकार का संरचनात्मक समरूपता - स्थिति समरूपता तब होता है जब कार्यात्मक समूह, व्यक्तिगत हेटेरोएटम या एकाधिक बंधन हाइड्रोकार्बन कंकाल के विभिन्न स्थानों में स्थित होते हैं। स्ट्रक्चरल आइसोमर्स संबंधित हो सकते हैं विभिन्न वर्गकार्बनिक यौगिक, इसलिए वे न केवल भौतिक बल्कि रासायनिक गुणों में भी भिन्न हो सकते हैं। अंजीर पर। 5 यौगिक सी 3 एच 8 ओ के लिए तीन आइसोमर दिखाता है, उनमें से दो अल्कोहल हैं, और तीसरा ईथर है
चावल। 5. स्थिति आइसोमर्स
अक्सर, स्थिति आइसोमर्स की संरचना में अंतर इतना स्पष्ट होता है कि उन्हें मानसिक रूप से अंतरिक्ष में संयोजित करना भी आवश्यक नहीं है, उदाहरण के लिए, ब्यूटेन या डाइक्लोरोबेंजीन के आइसोमर्स (चित्र 6):
चावल। 6. ब्यूटेन तथा डाइक्लोरोबेंजीन के समावयवी
कभी-कभी संरचनात्मक समावयवी हाइड्रोकार्बन कंकाल समरूपता और स्थितीय समावयवता (चित्र 7) की विशेषताओं को मिलाते हैं।
चावल। 7. दो प्रकार के संरचनात्मक समरूपता का संयोजन
समावयवता के प्रश्नों में सैद्धांतिक विचार और प्रयोग परस्पर जुड़े हुए हैं। यदि विचार बताते हैं कि कोई आइसोमर नहीं हो सकता है, तो प्रयोगों को वही दिखाना चाहिए। यदि गणना इंगित करती है निश्चित संख्याआइसोमर्स, तो उन्हें एक ही राशि, या उससे कम प्राप्त किया जा सकता है, लेकिन अधिक नहीं - सैद्धांतिक रूप से गणना किए गए सभी आइसोमर्स प्राप्त नहीं किए जा सकते हैं, क्योंकि प्रस्तावित आइसोमर में अंतर-परमाणु दूरी या बंधन कोण सीमा से बाहर हो सकते हैं। छह सीएच समूहों (उदाहरण के लिए, बेंजीन) वाले पदार्थ के लिए, 6 आइसोमर सैद्धांतिक रूप से संभव हैं (चित्र। 8)।
चावल। 8. बेंजीन आइसोमर्स
दिखाए गए आइसोमर्स में से पहले पांच मौजूद हैं (दूसरा, तीसरा, चौथा और पांचवां आइसोमर बेंजीन की संरचना की स्थापना के लगभग 100 साल बाद प्राप्त किए गए थे)। अंतिम आइसोमर सबसे अधिक संभावना कभी प्राप्त नहीं होगी। एक षट्भुज के रूप में प्रस्तुत, यह कम से कम संभावना है, इसकी विकृतियां एक तिरछे प्रिज्म, एक तीन-बीम स्टार, एक अधूरा पिरामिड और एक डबल पिरामिड (एक अधूरा ऑक्टाहेड्रोन) के रूप में संरचनाओं की ओर ले जाती हैं। इन विकल्पों में से प्रत्येक में या तो बहुत भिन्न सीसी बांड हैं, या दृढ़ता से विकृत बांड कोण हैं (चित्र 9):
रासायनिक परिवर्तन, जिसके परिणामस्वरूप संरचनात्मक समावयव एक दूसरे में परिवर्तित हो जाते हैं, समावयवीकरण कहलाते हैं।
स्टीरियोइसोमेरिज्म
अंतरिक्ष में परमाणुओं की उनके बीच बंधों के समान क्रम के साथ अलग-अलग व्यवस्था के कारण उत्पन्न होता है।
स्टीरियोइसोमेरिज्म के प्रकारों में से एक सीआईएस-ट्रांस-आइसोमरिज्म है (सीआईएस - अक्षां. एक तरफ, ट्रांस - अक्षां. के माध्यम से, विपरीत पक्षों पर) कई बंधों या समतल चक्रों वाले यौगिकों में देखा जाता है। एक एकल बंधन के विपरीत, एक बहु बंधन अणु के अलग-अलग टुकड़ों को इसके चारों ओर घूमने की अनुमति नहीं देता है। आइसोमर के प्रकार को निर्धारित करने के लिए, एक विमान को मानसिक रूप से दोहरे बंधन के माध्यम से खींचा जाता है और फिर जिस तरह से इस विमान के सापेक्ष स्थानापन्नों को रखा जाता है, उसका विश्लेषण किया जाता है। यदि समरूप समूह समतल के एक ही ओर हों, तो यह सीआईएस-आइसोमर, यदि विपरीत दिशा में - ट्रांस-आइसोमर:
भौतिक और रासायनिक गुण सीआईएस- तथा ट्रांस-आइसोमर कभी-कभी अलग-अलग होते हैं, मेलिक एसिड में कार्बोक्सिल समूह -COOH स्थानिक रूप से करीब होते हैं, वे प्रतिक्रिया कर सकते हैं (चित्र 11), मैलिक एनहाइड्राइड (फ्यूमरिक एसिड के लिए, यह प्रतिक्रिया नहीं होती है):
चावल। 11. मैलिक एनहाइड्राइड का निर्माण
तलीय चक्रीय अणुओं के मामले में, मानसिक रूप से एक विमान खींचना आवश्यक नहीं है, क्योंकि यह पहले से ही अणु के आकार से निर्धारित होता है, उदाहरण के लिए, चक्रीय सिलोक्सेन (चित्र। 12) में:
चावल। 12. साइक्लोसिलोक्सेन के आइसोमर्स
धातुओं के जटिल यौगिकों में सीआईएसएक समावयवी एक यौगिक है जिसमें दो समान समूह, जो धातु को घेरते हैं, आसन्न होते हैं, में ट्रांस-आइसोमर, उन्हें अन्य समूहों द्वारा अलग किया जाता है (चित्र 13):
चावल। 13. कोबाल्ट परिसर के आइसोमर्स
दूसरे प्रकार का स्टीरियोइसोमेरिज्म - ऑप्टिकल आइसोमेरिज्म तब होता है जब दो आइसोमर (पहले तैयार की गई परिभाषा के अनुसार, दो अणु जो अंतरिक्ष में संगत नहीं हैं) हैं दर्पण प्रतिबिंबएक दूसरे। अणु जिन्हें चार अलग-अलग पदार्थों के साथ एकल कार्बन परमाणु के रूप में दर्शाया जा सकता है, उनमें यह गुण होता है। चार प्रतिस्थापकों से जुड़े केंद्रीय कार्बन परमाणु की संयोजकता मानसिक चतुष्फलक के शीर्षों की ओर निर्देशित होती है - एक नियमित चतुष्फलक ( सेमी। ORBITAL) और सख्ती से तय किए गए हैं। अंजीर में चार अलग-अलग पदार्थ दिखाए गए हैं। 14 अलग-अलग रंगों की चार गेंदों के रूप में:
चावल। 14. एक कार्बन परमाणु जिसमें चार अलग-अलग पदार्थ होते हैं
एक ऑप्टिकल आइसोमर के संभावित गठन का पता लगाने के लिए, दर्पण में अणु को प्रतिबिंबित करना आवश्यक है (चित्र। 15), फिर दर्पण छवि को वास्तविक अणु के रूप में लिया जाना चाहिए, मूल के नीचे रखा जाना चाहिए ताकि उनकी ऊर्ध्वाधर कुल्हाड़ियों का संयोग हो, और दूसरे अणु को ऊर्ध्वाधर अक्ष के चारों ओर घुमाएं ताकि लाल गेंद ऊपरी और निचले अणु एक दूसरे के नीचे स्थित हो। नतीजतन, केवल दो गेंदों की स्थिति, बेज और लाल, मेल खाती है (दोहरे तीरों के साथ चिह्नित)। यदि आप निचले अणु को घुमाते हैं ताकि नीली गेंदें संरेखित हों, तो केवल दो गेंदों, बेज और नीले रंग की स्थिति फिर से मेल खाएगी (दोहरे तीरों के साथ भी चिह्नित)। सब कुछ स्पष्ट हो जाता है यदि इन दो अणुओं को अंतरिक्ष में मानसिक रूप से संयोजित किया जाता है, एक को दूसरे में डाल दिया जाता है, जैसे कि म्यान में चाकू, लाल और हरे रंग की गेंद मेल नहीं खाती:
ऐसे दो अणुओं के अंतरिक्ष में किसी भी पारस्परिक अभिविन्यास के लिए, संयुक्त होने पर पूर्ण संयोग प्राप्त करना असंभव है, परिभाषा के अनुसार, ये आइसोमर हैं। यह ध्यान रखना महत्वपूर्ण है कि यदि केंद्रीय कार्बन परमाणु में चार नहीं, बल्कि केवल तीन अलग-अलग पदार्थ हैं (अर्थात, उनमें से दो समान हैं), तो जब ऐसा अणु दर्पण में परिलक्षित होता है, तो एक ऑप्टिकल आइसोमर नहीं बनता है, चूँकि अणु और उसके परावर्तन को अंतरिक्ष में जोड़ा जा सकता है (चित्र 16):
कार्बन के अलावा, अन्य परमाणु असममित केंद्रों के रूप में कार्य कर सकते हैं, जिसमें सहसंयोजी आबंधटेट्राहेड्रोन के कोनों के लिए निर्देशित, उदाहरण के लिए, सिलिकॉन, टिन, फास्फोरस।
ऑप्टिकल आइसोमेरिज्म न केवल एक असममित परमाणु के मामले में उत्पन्न होता है, यह कुछ ढांचे के अणुओं में एक निश्चित संख्या में विभिन्न पदार्थों की उपस्थिति में भी महसूस किया जाता है। उदाहरण के लिए, फ्रेम हाइड्रोकार्बन एडमैंटेन, जिसमें चार अलग-अलग पदार्थ होते हैं (चित्र 17), में एक ऑप्टिकल आइसोमर हो सकता है, जबकि पूरा अणु एक असममित केंद्र की भूमिका निभाता है, जो स्पष्ट हो जाता है कि अगर एडमेंटेन का फ्रेम मानसिक रूप से अनुबंधित है। बिंदु। इसी तरह, सिलोक्सेन, जिसमें घन संरचना होती है (चित्र 17), भी चार अलग-अलग पदार्थों के मामले में वैकल्पिक रूप से सक्रिय हो जाता है:
चावल। 17. वैकल्पिक रूप से सक्रिय ढांचे के अणु
वेरिएंट तब संभव होते हैं जब अणु में एक अव्यक्त रूप में भी एक असममित केंद्र नहीं होता है, लेकिन स्वयं आम तौर पर असममित हो सकता है, जबकि ऑप्टिकल आइसोमर्स भी संभव हैं। उदाहरण के लिए, बेरिलियम के एक जटिल परिसर में, दो चक्रीय टुकड़े परस्पर लंबवत विमानों में स्थित होते हैं; इस मामले में, ऑप्टिकल आइसोमर (छवि 18) प्राप्त करने के लिए दो अलग-अलग प्रतिस्थापन पर्याप्त हैं। फेरोसिन अणु के लिए, जिसमें पांच-तरफा प्रिज्म का आकार होता है, एक ही उद्देश्य के लिए तीन प्रतिस्थापन की आवश्यकता होती है, इस मामले में हाइड्रोजन परमाणु प्रतिस्थापनों में से एक की भूमिका निभाता है (चित्र 18):
चावल। 18. असममित अणुओं का ऑप्टिकल समरूपता
ज्यादातर मामलों में, किसी यौगिक का संरचनात्मक सूत्र यह समझना संभव बनाता है कि पदार्थ को वैकल्पिक रूप से सक्रिय बनाने के लिए उसमें वास्तव में क्या बदला जाना चाहिए।
वैकल्पिक रूप से सक्रिय स्टीरियोइसोमर्स को संश्लेषित करते समय, आमतौर पर डेक्सट्रोरोटेटरी और लीवरोटेटरी यौगिकों का मिश्रण प्राप्त होता है। आइसोमर्स का पृथक्करण अभिकर्मकों के साथ आइसोमर्स के मिश्रण पर प्रतिक्रिया करके किया जाता है (अधिक बार प्राकृतिक उत्पत्ति) एक असममित प्रतिक्रिया केंद्र युक्त। बैक्टीरिया सहित कुछ जीवित जीव, बाएं हाथ के आइसोमर्स को अधिमानतः चयापचय करते हैं।
वर्तमान में, प्रक्रियाओं (असममित संश्लेषण कहा जाता है) को विकसित किया गया है जो एक विशिष्ट ऑप्टिकल आइसोमर को उद्देश्यपूर्ण रूप से प्राप्त करना संभव बनाता है।
ऐसी प्रतिक्रियाएं हैं जो एक ऑप्टिकल आइसोमर को उसके एंटीपोड में परिवर्तित करना संभव बनाती हैं ( सेमी. वाल्डेन वार्तालाप)।
मिखाइल लेवित्स्की
व्याख्यान #5
थीम "आइसोमेरिज्म और इसके प्रकार"
पाठ का प्रकार: संयुक्त
उद्देश्य: 1. समावयवता की घटना पर संरचना के सिद्धांत की मुख्य स्थिति को प्रकट करने के लिए। समावयवता के प्रकारों का एक सामान्य विचार दीजिए। स्टीरियोइसोमेरिज़्म के उदाहरण पर संरचना के सिद्धांत के विकास में मुख्य दिशाएँ दिखाएँ।
2. आइसोमर्स के फॉर्मूले बनाने की क्षमता बनाना जारी रखें, फॉर्मूले के अनुसार पदार्थों को नाम दें।
3. सीखने के लिए एक संज्ञानात्मक दृष्टिकोण विकसित करें
उपकरण: स्टुअर्ट-ब्रीगलब अणु मॉडल, रंगीन प्लास्टिसिन, माचिस, दस्ताने की एक जोड़ी, जीरा, पुदीना च्युइंग गम, तीन टेस्ट ट्यूब।
शिक्षण योजना
अभिवादन, रोल कॉल
बुनियादी ज्ञान का सर्वेक्षण
नई सामग्री सीखना:
संरचना का सिद्धांत और समरूपता की घटना;
समरूपता के प्रकार;
एंकरिंग
सबक प्रगति
2. बुनियादी ज्ञान का सर्वेक्षण: सामने से
कार्बनिक यौगिकों को किस मानदंड के अनुसार वर्गीकृत किया जाता है, एक आरेख का उपयोग करके समझाएं।
कार्बनिक यौगिकों के मुख्य वर्ग क्या हैं, उनकी संरचना की विशेषताएं
व्यायाम नंबर 1 और 2 6 करें। ब्लैकबोर्ड पर एक छात्र, बाकी नोटबुक में
3. नई सामग्री सीखना: संरचना का सिद्धांत और समरूपता की घटना
समावयवता और समावयवता की परिभाषा को याद कीजिए। उनके अस्तित्व का कारण स्पष्ट कीजिए।
आइसोमेरिज्म की घटना (ग्रीक आइसोस से - अलग और मेरोस - शेयर, भाग) की खोज 1823 में जे। लिबिग और एफ। वेहलर ने दो अकार्बनिक एसिड के लवण के उदाहरण का उपयोग करके की थी: साइनिक और फुलमिनेंट। नाक = एन सियान; एच-ओ-एन = सी रैटलिंग
1830 में, जे. डुमास ने समावयवता की अवधारणा को कार्बनिक यौगिकों तक विस्तारित किया। शब्द "आइसोमर" एक साल बाद सामने आया, और जे. बर्ज़ेलियस द्वारा सुझाया गया था। क्योंकि संरचना के क्षेत्र में जैविक और दोनों अकार्बनिक पदार्थउस समय, पूर्ण अराजकता का शासन था, खोज को ज्यादा महत्व नहीं दिया गया था।
एएम बटलरोव द्वारा संरचना के सिद्धांत के ढांचे के भीतर आइसोमेरिज्म की घटना के लिए एक वैज्ञानिक स्पष्टीकरण दिया गया था, जबकि न तो प्रकार के सिद्धांत और न ही कट्टरपंथियों के सिद्धांत ने इस घटना के सार को प्रकट किया। एएम बटलरोव ने आइसोमेरिज्म का कारण इस तथ्य में देखा कि आइसोमर्स के अणुओं में परमाणु एक अलग क्रम में जुड़े हुए हैं। संरचना के सिद्धांत ने संभावित आइसोमर्स और उनकी संरचना की संख्या की भविष्यवाणी करना संभव बना दिया, जिसे ए.एम. बटलरोव और उनके अनुयायियों द्वारा अभ्यास में शानदार ढंग से पुष्टि की गई थी।
समावयवता के प्रकार: समावयवों का एक उदाहरण दीजिए और एक विशेषता सुझाइए जिसके द्वारा समावयवों को वर्गीकृत किया जा सकता है?(जाहिर है, आधार आइसोमर्स के अणुओं की संरचना होगी)। मैं आरेख का उपयोग करके सामग्री की व्याख्या करता हूं:
दो प्रकार के आइसोमेरिज्म हैं: संरचनात्मक और स्थानिक (स्टीरियोइसोमेरिज्म)। संरचनात्मक आइसोमर्स वे होते हैं जिनके अणु में परमाणुओं के बंधन का एक अलग क्रम होता है। स्थानिक समावयवों के प्रत्येक कार्बन परमाणु पर समान स्थानापन्न होते हैं, लेकिन उनमें भिन्नता होती है आपसी व्यवस्थाअंतरिक्ष में।
स्ट्रक्चरल आइसोमेरिज्म तीन प्रकार का होता है: कार्बन कंकाल की संरचना से जुड़ा इंटरक्लास आइसोमेरिज्म, और फंक्शनल ग्रुप या मल्टीपल बॉन्ड की स्थिति का आइसोमेरिज्म।
इंटरक्लास आइसोमर्स में विभिन्न कार्यात्मक समूह होते हैं और कार्बनिक यौगिकों के विभिन्न वर्गों से संबंधित होते हैं, और इसलिए इंटरक्लास आइसोमर्स के भौतिक और रासायनिक गुण काफी भिन्न होते हैं।
कार्बन कंकाल का समरूपता आप पहले से ही परिचित हैं, भौतिक गुण भिन्न हैं, और रासायनिक गुण समान हैं, क्योंकि ये पदार्थ एक ही वर्ग के हैं।
एक कार्यात्मक समूह की स्थिति या कई बंधों की स्थिति का समरूपता। ऐसे आइसोमर्स के भौतिक गुण भिन्न होते हैं, लेकिन रासायनिक गुण समान होते हैं।
ज्यामितीय समरूपता: विभिन्न भौतिक स्थिरांक होते हैं लेकिन समान रासायनिक गुण होते हैं

प्रकाशिक समावयवी एक दूसरे के दर्पण प्रतिबिम्ब होते हैं; दो हथेलियों की तरह, उन्हें एक साथ रखना असंभव है ताकि वे मेल खा सकें।


4. फिक्सिंग: आइसोमर्स को पहचानें, उन पदार्थों में आइसोमेरिज्म के प्रकार का निर्धारण करें जिनके सूत्र: व्यायाम करें 3 7
कार्बनिक रसायन विज्ञान में आइसोमर सबसे महत्वपूर्ण अवधारणा है। समान संरचना और आणविक भार वाले पदार्थ उनकी संरचना में समान तत्वों की संरचना और संयोजन में भिन्न हो सकते हैं। ये तत्व समान मात्रा में निहित हैं, लेकिन परमाणुओं के समूहों या केवल परमाणुओं की स्थानिक व्यवस्था में भिन्न हैं। ऐसे पदार्थों को आइसोमर कहा जाता है।
सरलतम आइसोमर्स के उदाहरण पर - ब्यूटेन और आइसोब्यूटेन (या बल्कि, उनके संरचनात्मक सूत्र), जिनका आणविक सूत्र C4 H10 बिल्कुल समान है, कोई भी आसानी से समझ सकता है कि क्या है प्रश्न में. ब्यूटेन का संरचनात्मक सूत्र इस तरह दिखता है: CH3-CH2-CH2-CH3 और आइसोब्यूटेन CH3-CH (CH3)-CH3। कार्बन और हाइड्रोजन परमाणुओं की स्थानिक व्यवस्था, साथ ही उनके कनेक्शन क्रम, ब्यूटेन और आइसोब्यूटेन में भिन्न होते हैं।
इसके अलावा, आइसोब्यूटेन (जो ब्यूटेन में अनुपस्थित है) में -CH3 कट्टरपंथी समूह दूसरे कार्बन परमाणु से जुड़ा होता है और एक शाखा बनाता है। आइसोब्यूटेन में –CH3 रेडिकल समूह की उपस्थिति के कारण इसमें –CH समूह दिखाई देता है। ब्यूटेन में, परमाणुओं के सभी समूह रैखिक रूप से जुड़े होते हैं, और इसके अलावा, आइसोब्यूटेन के विपरीत, इसमें दो -CH2 समूह होते हैं।
आइसोमर्स क्या हैं
आइसोमरों- विशेष रासायनिक यौगिकएक ही सूत्र और संरचना के साथ संपन्न, लेकिन संरचना और गुणों में भिन्न। आइसोमर्स मुख्य रूप से कार्बनिक यौगिकों में निहित हैं।
यदि समान यौगिकों वाले दो यौगिकों के अणु, जब अंतरिक्ष में संयुक्त होते हैं, पूरी तरह से मेल नहीं खाते हैं, तो उन्हें आइसोमर माना जाता है। आइसोमर्स के गुण उनकी रचनाओं पर नहीं, बल्कि उनकी रासायनिक संरचना पर, अधिक सटीक रूप से, उस क्रम पर निर्भर करते हैं जिसमें अणु बनाने वाले परमाणु जुड़े होते हैं, और एक दूसरे पर परमाणुओं के पारस्परिक प्रभाव पर।
आइसोमर्स की तुलना
आइसोमर्स में क्या अंतर है? एक ही रचना वाले आइसोमर्स अलग-अलग होते हैं भौतिक रासायनिक गुण. यह इस तथ्य के कारण है कि अणुओं में परमाणुओं को एक असमान क्रम में व्यवस्थित किया जाता है। संरचनात्मक आइसोमर्स हाइड्रोकार्बन कंकाल की संरचना में, या कई बांडों या कार्यात्मक समूहों के अलग-अलग स्थान में भिन्न होते हैं, जो विभिन्न भौतिक रासायनिक गुणों की ओर जाता है।
स्टीरियोइसोमर्स (सीआईएस- और ट्रांस-आइसोमर्स) में परमाणुओं और अंतरिक्ष में उनकी अलग व्यवस्था के बीच बंधनों का एक ही क्रम होता है। स्टीरियोइसोमर्स के गुण स्पष्ट रूप से भिन्न होते हैं।
उदाहरण के लिए, जिन पदार्थों का सूत्र C2H6O है, वे दो पूरी तरह से अलग आइसोमेरिक कार्बनिक यौगिक हैं: डाइमिथाइल ईथर (एक गैस जो पानी में न्यूनतम घुलनशील है) और इथेनॉल(78 डिग्री सेल्सियस पर तरल उबल रहा है)। वे कार्बनिक यौगिकों के पूरी तरह से अलग वर्गों (ईथर और अल्कोहल) से संबंधित हैं। उनके रासायनिक गुण काफी भिन्न होते हैं।
TheDifference.ru ने निर्धारित किया कि आइसोमर्स के बीच का अंतर इस प्रकार है:
संरचनात्मक सूत्रों में परमाणुओं को बांधने का क्रम भिन्न होता है।
आइसोमर्स के कार्बन कंकाल की संरचना समान नहीं है, इसकी अपनी विशिष्ट विशेषताएं हैं।
आइसोमर्स में कई बॉन्ड अलग-अलग तरीकों से स्थित होते हैं।
आइसोमर्स में कार्यात्मक समूहों का स्थान भिन्न होता है।
अंतरिक्ष में परमाणुओं को विभिन्न स्थितियों में रखा जाता है।
आइसोमर्स के भौतिक रासायनिक गुण नाटकीय रूप से भिन्न हो सकते हैं।
1. संरचनात्मक समरूपता।
2. गठनात्मक समरूपता।
3. ज्यामितीय समरूपता।
4. ऑप्टिकल आइसोमेरिज्म।
आइसोमरोंवे पदार्थ हैं जिनकी संरचना और आणविक भार समान हैं, लेकिन विभिन्न भौतिक और रासायनिक गुण हैं। आइसोमर्स के गुणों में अंतर उनके रासायनिक या स्थानिक संरचना में अंतर के कारण होता है। इस संबंध में, दो प्रकार के आइसोमेरिज्म हैं।
संवयविता
संरचनात्मक
स्थानिक
कार्बन कंकाल
विन्यास
गठनात्मक
कार्यात्मक की स्थिति
ऑप्टिकल
इंटरक्लास
ज्यामितिक
1. संरचनात्मक समरूपता
संरचनात्मक आइसोमर्स रासायनिक संरचना में भिन्न होते हैं, अर्थात। एक अणु में परमाणुओं के बीच बंधों की प्रकृति और अनुक्रम। संरचनात्मक आइसोमर्स शुद्ध रूप में पृथक होते हैं। वे व्यक्तिगत, स्थिर पदार्थों के रूप में मौजूद हैं, उनके पारस्परिक परिवर्तन के लिए उच्च ऊर्जा की आवश्यकता होती है - लगभग 350 - 400 kJ / mol। केवल संरचनात्मक समावयवी, टॉटोमर्स, गतिशील संतुलन में हैं। कार्बनिक रसायन विज्ञान में टॉटोमेरिज्म एक सामान्य घटना है। यह एक अणु (कार्बोनिल यौगिक, एमाइन, हेटरोसायकल, आदि), इंट्रामोल्युलर इंटरैक्शन (कार्बोहाइड्रेट) में एक मोबाइल हाइड्रोजन परमाणु के हस्तांतरण के साथ संभव है।
सभी संरचनात्मक समावयवों को संरचनात्मक सूत्रों के रूप में प्रस्तुत किया जाता है और IUPAC नामकरण के अनुसार नामित किया जाता है। उदाहरण के लिए, सी 4 एच 8 ओ की संरचना संरचनात्मक आइसोमर्स से मेल खाती है:
एक)विभिन्न कार्बन कंकाल के साथ
असंबद्ध सी-श्रृंखला - सीएच 3 -सीएच 2 -सीएच 2 -सीएच \u003d ओ (ब्यूटेनल, एल्डिहाइड) और
शाखित सी-चेन -
 (2-मिथाइलप्रोपेनल, एल्डिहाइड) या
(2-मिथाइलप्रोपेनल, एल्डिहाइड) या
चक्र -  (साइक्लोबुटानॉल, चक्रीय अल्कोहल);
(साइक्लोबुटानॉल, चक्रीय अल्कोहल);
बी)कार्यात्मक समूह की एक अलग स्थिति के साथ
 ब्यूटेनोन-2, कीटोन;
ब्यूटेनोन-2, कीटोन;
में)कार्यात्मक समूह की विभिन्न संरचना के साथ
 3-ब्यूटेनॉल-2, असंतृप्त अल्कोहल;
3-ब्यूटेनॉल-2, असंतृप्त अल्कोहल;
जी)मेटामेरिज्म
कार्यात्मक समूह के हेटेरोएटम को कार्बन कंकाल (चक्र या श्रृंखला) में शामिल किया जा सकता है। इस प्रकार के आइसोमेरिज्म के संभावित आइसोमरों में से एक सीएच 3 -ओ-सीएच 2 -सीएच \u003d सीएच 2 (3-मेथॉक्सीप्रोपीन -1, सरल ईथर) है;
इ)टॉटोमेरिज़्म (कीटो-एनोल)
एनोल फॉर्म  कीटो फॉर्म
कीटो फॉर्म
टॉटोमर्स गतिशील संतुलन में होते हैं, जबकि अधिक स्थिर रूप, कीटो रूप, मिश्रण में प्रमुख होता है।
सुगंधित यौगिकों के लिए, संरचनात्मक समरूपता को केवल पार्श्व श्रृंखला के लिए माना जाता है।
2. स्थानिक समरूपता (स्टीरियोइसोमेरिज्म)
स्थानिक आइसोमर्स में समान रासायनिक संरचना होती है, अणु में परमाणुओं की स्थानिक व्यवस्था में भिन्न होती है। यह अंतर भौतिक और में अंतर पैदा करता है रासायनिक गुण. स्थानिक आइसोमर्स को विभिन्न अनुमानों या स्टीरियोकेमिकल फ़ार्मुलों के रूप में दर्शाया गया है। रसायन विज्ञान की वह शाखा जो यौगिकों के भौतिक और रासायनिक गुणों पर उनकी प्रतिक्रियाओं की दिशा और दर पर स्थानिक संरचना और इसके प्रभाव का अध्ययन करती है, स्टीरियोकेमिस्ट्री कहलाती है।
एक)गठनात्मक (घूर्णी) समरूपता
बॉन्ड एंगल या बॉन्ड की लंबाई को बदले बिना, कोई एक अणु के कई ज्यामितीय आकार (रूपांतरण) की कल्पना कर सकता है जो कार्बन टेट्राहेड्रा के पारस्परिक रोटेशन द्वारा उन्हें जोड़ने वाले -C-C बॉन्ड के चारों ओर एक दूसरे से भिन्न होते हैं। इस तरह के रोटेशन के परिणामस्वरूप, घूर्णी आइसोमर्स (कन्फॉर्मर्स) उत्पन्न होते हैं। विभिन्न कन्फर्मर्स की ऊर्जा समान नहीं होती है, लेकिन अधिकांश कार्बनिक यौगिकों के लिए विभिन्न कंफर्मल आइसोमर्स को अलग करने वाला ऊर्जा अवरोध छोटा होता है। इसलिए, सामान्य परिस्थितियों में, एक नियम के रूप में, एक कड़ाई से परिभाषित संरचना में अणुओं को ठीक करना असंभव है। आमतौर पर, कई गठनात्मक आइसोमर्स संतुलन में सह-अस्तित्व में होते हैं।
इथेन अणु के उदाहरण का उपयोग करके छवि विधियों और आइसोमर्स के नामकरण पर विचार किया जा सकता है। इसके लिए, कोई भी दो अनुरूपताओं के अस्तित्व की भविष्यवाणी कर सकता है जो ऊर्जा में जितना संभव हो उतना भिन्न होता है, जिसे इस रूप में दर्शाया जा सकता है परिप्रेक्ष्य अनुमान(1) ("आरी घोड़े") या अनुमान नया आदमी(2):

बाधित रचना ग्रहण की गई रचना
एक परिप्रेक्ष्य प्रक्षेपण (1) में, सी-सी कनेक्शन की कल्पना दूरी में जाने के रूप में की जानी चाहिए; बायीं ओर खड़ा कार्बन परमाणु प्रेक्षक के निकट होता है, दायीं ओर खड़े होकर उसमें से हटा दिया जाता है।
न्यूमैन प्रोजेक्शन (2) में, अणु को सी-सी बॉन्ड के साथ देखा जाता है। वृत्त के केंद्र से 120 o के कोण पर विचलन करने वाली तीन रेखाएँ प्रेक्षक के निकटतम कार्बन परमाणु के बंधों को दर्शाती हैं; वृत्त के पीछे से "बाहर निकली" रेखाएँ दूरस्थ कार्बन परमाणु के बंधन हैं।
दाईं ओर दिखाई गई रचना को कहा जाता है अस्पष्ट . यह नाम इस तथ्य की याद दिलाता है कि दोनों सीएच 3 समूहों के हाइड्रोजन परमाणु एक दूसरे के विपरीत हैं। परिरक्षित संरचना में आंतरिक ऊर्जा में वृद्धि हुई है और इसलिए यह प्रतिकूल है। बाईं ओर दिखाई गई रचना कहलाती है संकोची , जिसका अर्थ है कि सीसी बांड के चारों ओर मुक्त रोटेशन इस स्थिति में "धीमा" हो जाता है, अर्थात। इस रचना में अणु मुख्य रूप से मौजूद है।
किसी विशेष बंधन के चारों ओर एक अणु के पूर्ण घूर्णन के लिए आवश्यक न्यूनतम ऊर्जा उस बंधन के लिए घूर्णन बाधा कहलाती है। एथेन जैसे अणु में घूर्णी अवरोध को अणु की स्थितिज ऊर्जा में परिवर्तन के रूप में प्रणाली के डायहेड्रल (मरोड़ - τ) कोण में परिवर्तन के एक समारोह के रूप में व्यक्त किया जा सकता है। ईथेन में सीसी बांड के चारों ओर घूमने की ऊर्जा प्रोफ़ाइल चित्र 1 में दिखाई गई है। ईथेन के दो रूपों को अलग करने वाला घूर्णी अवरोध लगभग 3 kcal/mol (12.6 kJ/mol) है। संभावित ऊर्जा वक्र की मिनिमा बाधित अनुरूपताओं के अनुरूप है, मैक्सिमा अस्पष्ट लोगों के अनुरूप है। चूंकि कमरे के तापमान पर अणुओं के कुछ टकरावों की ऊर्जा 20 kcal / mol (लगभग 80 kJ / mol) तक पहुँच सकती है, 12.6 kJ / mol का यह अवरोध आसानी से दूर हो जाता है और ईथेन में रोटेशन को मुक्त माना जाता है। सभी संभावित अनुरूपताओं के मिश्रण में, बाधित अनुरूपताएं प्रबल होती हैं।

चित्र एक। ईथेन अनुरूपताओं की संभावित ऊर्जा आरेख।
अधिक जटिल अणुओं के लिए, संभावित अनुरूपताओं की संख्या बढ़ जाती है। इसके लिए हां एन-ब्यूटेन को पहले से ही छह अनुरूपताओं में चित्रित किया जा सकता है जो केंद्रीय बंधन सी 2 - सी 3 के चारों ओर घूमते समय उत्पन्न होते हैं और सीएच 3 समूहों की पारस्परिक व्यवस्था में भिन्न होते हैं। ब्यूटेन की विभिन्न ग्रहण और बाधित रचनाएं ऊर्जा में भिन्न होती हैं। बाधित रचनाएँ ऊर्जावान रूप से अधिक अनुकूल होती हैं।

ब्यूटेन में C 2 -C 3 बंध के चारों ओर घूमने की ऊर्जा प्रोफ़ाइल चित्र 2 में दिखाई गई है।

रेखा चित्र नम्बर 2। एन-ब्यूटेन अनुरूपताओं की संभावित ऊर्जा आरेख।
एक लंबी कार्बन श्रृंखला वाले अणु के लिए, गठनात्मक रूपों की संख्या बढ़ जाती है।
ऐलिसाइक्लिक यौगिकों के अणुओं को वलय के विभिन्न गठनात्मक रूपों की विशेषता होती है (उदाहरण के लिए, साइक्लोहेक्सेन के लिए) बंहदार कुरसी, स्नान, मोड़-फॉर्म)।
तो, रचनाएँ एक अणु के विभिन्न स्थानिक रूप हैं जिनका एक निश्चित विन्यास होता है। कंफर्मर्स स्टीरियोइसोमेरिक संरचनाएं हैं जो संभावित ऊर्जा आरेख पर ऊर्जा मिनिमा के अनुरूप हैं, मोबाइल संतुलन में हैं और सरल σ-बॉन्ड के चारों ओर रोटेशन द्वारा इंटरकनवर्ज़न करने में सक्षम हैं।
यदि इस तरह के परिवर्तनों की बाधा काफी अधिक हो जाती है, तो स्टीरियोइसोमेरिक रूपों को अलग किया जा सकता है (एक उदाहरण वैकल्पिक रूप से सक्रिय बाइफिनाइल है)। ऐसे मामलों में, कोई अब कंफर्मर्स की बात नहीं करता है, बल्कि वास्तव में मौजूदा स्टीरियोइसोमर्स की बात करता है।
बी)ज्यामितीय समरूपता
अणु में अनुपस्थिति के परिणामस्वरूप ज्यामितीय आइसोमर उत्पन्न होते हैं:
1. एक दूसरे के सापेक्ष कार्बन परमाणुओं का घूमना - सी = सी डबल बॉन्ड या चक्रीय संरचना की कठोरता का परिणाम;
2. दोहरे बंधन या चक्र के एक कार्बन परमाणु पर दो समान समूह।
कंफर्मर्स के विपरीत ज्यामितीय आइसोमर्स को शुद्ध रूप में अलग किया जा सकता है और व्यक्तिगत, स्थिर पदार्थों के रूप में मौजूद हो सकता है। उनके पारस्परिक परिवर्तन के लिए, एक उच्च ऊर्जा की आवश्यकता होती है - लगभग 125-170 kJ / mol (30-40 kcal / mol)।
सीआईएस-ट्रांस- (जेड, ई) आइसोमर्स हैं; सीआईएस- रूपों को कहा जाता है ज्यामितीय समावयवी, जिसमें समान प्रतिस्थापन π-बंध या चक्र के तल के एक ही तरफ स्थित होते हैं, ट्रान्स- रूपों को ज्यामितीय समावयवी कहा जाता है, जिसमें समान प्रतिस्थापन -बंध या वलय के तल के विपरीत पक्षों पर स्थित होते हैं।
सबसे सरल उदाहरण ब्यूटेन-2 के समावयवी हैं, जो सिस-, ट्रांस-ज्यामितीय समावयवों के रूप में मौजूद हैं:


सीआईएस-ब्यूटेन-2 ट्रांस-ब्यूटेन-2
पिघलने का तापमान
138.9 0 - 105.6 0
उबलता तापमान
3.72 0 1.00 0
घनत्व
1,2 - डाइक्लोरोसाइक्लोप्रोपेन सीआईएस-, ट्रांस-आइसोमर्स के रूप में मौजूद है:


सीआईएस-1,2-डाइक्लोरोसाइक्लोप्रोपेन ट्रांस-1,2-डाइक्लोरोसाइक्लोप्रोपेन
अधिक जटिल मामलों में, आवेदन करें जेड,ई-नामकरण (कन्न, इंगोल्ड, प्रीलॉग का नामकरण - केआईपी, प्रतिनियुक्ति की वरिष्ठता का नामकरण)। संयोजन में
1-ब्रोमो -2-मिथाइल-1-क्लोरोब्यूटिन -1 (Br) (CI) C \u003d C (CH 3) - CH 2 -CH 3 कार्बन परमाणुओं में दोहरे बंधन वाले सभी पदार्थ अलग-अलग हैं; इसलिए, यह यौगिक Z-, E- ज्यामितीय समावयवों के रूप में मौजूद है:


-1-ब्रोमो-2-मिथाइल-1-क्लोरोब्यूटीन-1 Z-1-ब्रोमो-2-मिथाइल-1-क्लोरोब्यूटीन-1।
एक समावयवी के विन्यास को इंगित करने के लिए, इंगित करें डबल बॉन्ड (या चक्र) में वरिष्ठ प्रतिस्थापन का स्थान - Z- (जर्मन ज़ुसामेन से - एक साथ) या ई- (जर्मन Entgegen से - विपरीत)।
जेड, ई-सिस्टम में, उच्च परमाणु संख्या वाले पदार्थों को वरिष्ठ माना जाता है। यदि असंतृप्त कार्बन परमाणुओं से सीधे जुड़े परमाणु समान हैं, तो वे "दूसरी परत" पर जाते हैं, यदि आवश्यक हो, तो "तीसरी परत" आदि पर जाते हैं।
पहले प्रक्षेपण में, पुराने समूह दोहरे बंधन के सापेक्ष एक दूसरे के विपरीत होते हैं, इसलिए यह ई आइसोमर है। दूसरे प्रक्षेपण में, पुराने समूह दोहरे बंधन (एक साथ) के एक ही तरफ हैं, इसलिए यह Z-आइसोमर है।
ज्यामितीय समावयवों को प्रकृति में व्यापक रूप से वितरित किया जाता है। उदाहरण के लिए, प्राकृतिक पॉलिमर रबर (सीआईएस-आइसोमर) और गुट्टा-पर्चा (ट्रांस-आइसोमर), प्राकृतिक फ्यूमरिक (ट्रांस-ब्यूटेनियोइक एसिड) और सिंथेटिक मैलिक (सीआईएस-ब्यूटेनियोइक एसिड) एसिड, वसा में सीआईएस-ओलिक, लिनोलिक, लिनोलेनिक एसिड होते हैं। .
में)ऑप्टिकल आइसोमेरिज्म
कार्बनिक यौगिकों के अणु चिरल और अचिरल हो सकते हैं। चिरायता (ग्रीक चीयर - हाथ से) - एक अणु की अपनी दर्पण छवि के साथ असंगति।
चिरल पदार्थ प्रकाश के ध्रुवीकरण के विमान को घुमाने में सक्षम हैं। इस घटना को ऑप्टिकल गतिविधि कहा जाता है, और संबंधित पदार्थ - दृष्टिगत रूप से सक्रिय. वैकल्पिक रूप से सक्रिय पदार्थ जोड़े में पाए जाते हैं ऑप्टिकल एंटीपोड- आइसोमर्स, जिनमें से भौतिक और रासायनिक गुण सामान्य परिस्थितियों में समान होते हैं, एक के अपवाद के साथ - ध्रुवीकरण विमान के रोटेशन का संकेत: ऑप्टिकल एंटीपोड्स में से एक ध्रुवीकरण विमान को दाईं ओर (+, डेक्सट्रोटेटरी आइसोमर) विक्षेपित करता है। , दूसरा - बाईं ओर (-, लीवरोटेटरी)। ऑप्टिकल एंटीपोड के विन्यास को एक उपकरण - एक पोलरिमीटर का उपयोग करके प्रयोगात्मक रूप से निर्धारित किया जा सकता है।
ऑप्टिकल आइसोमेरिज्म तब प्रकट होता है जब अणु में होता है असममित कार्बन परमाणु(अणु की चिरायता के अन्य कारण हैं). यह एसपी 3 में कार्बन परमाणु का नाम है - संकरण और चार अलग-अलग पदार्थों के साथ जुड़ा हुआ है। एक असममित परमाणु के चारों ओर प्रतिस्थापकों की दो चतुष्फलकीय व्यवस्थाएँ संभव हैं। एक ही समय में, दो स्थानिक रूपों को किसी भी रोटेशन द्वारा नहीं जोड़ा जा सकता है; उनमें से एक दूसरे की दर्पण छवि है:

दोनों दर्पण रूप ऑप्टिकल एंटीपोड की एक जोड़ी बनाते हैं या एनंटीओमर .
ई. फिशर प्रोजेक्शन सूत्रों के रूप में ऑप्टिकल आइसोमर्स को चित्रित करें। वे एक असममित कार्बन परमाणु के साथ एक अणु को प्रक्षेपित करके प्राप्त किए जाते हैं। इस मामले में, समतल पर असममित कार्बन परमाणु को एक बिंदु द्वारा दर्शाया जाता है, on क्षैतिज रेखाड्राइंग प्लेन के सामने उभरे हुए प्रतिस्थापकों के प्रतीकों को इंगित करें। ऊर्ध्वाधर रेखा (धराशायी या ठोस) उन पदार्थों को इंगित करती है जो आकृति के तल से हटा दिए जाते हैं। नीचे दिया गया हैं विभिन्न तरीकेपिछले आंकड़े में बाएं मॉडल के अनुरूप प्रक्षेपण सूत्र के रिकॉर्ड:

प्रक्षेपण में, मुख्य कार्बन श्रृंखला को लंबवत रूप से दर्शाया गया है; मुख्य कार्य, यदि यह श्रृंखला के अंत में है, प्रक्षेपण के शीर्ष पर इंगित किया गया है। उदाहरण के लिए, ऐलेनिन - सीएच 3 - * सीएच (एनएच 2) -सीओओएच के स्टीरियोकेमिकल और प्रक्षेपण सूत्र (+) और (-) इस प्रकार हैं:

Enantiomers की समान सामग्री वाले मिश्रण को रेसमेट कहा जाता है। रेसमेट में कोई ऑप्टिकल गतिविधि नहीं होती है और यह एनैन्टीओमर से भिन्न भौतिक गुणों की विशेषता होती है।
प्रक्षेपण सूत्रों को बदलने के नियम।
1. सूत्र को उनके स्टीरियोकेमिकल अर्थ को बदले बिना ड्राइंग के तल में 180 o घुमाया जा सकता है:

2. एक असममित परमाणु पर प्रतिस्थापन के दो (या कोई भी संख्या) क्रमपरिवर्तन सूत्र के स्टीरियोकेमिकल अर्थ को नहीं बदलते हैं:

3. असममित केंद्र पर प्रतिस्थापन के एक (या कोई विषम संख्या) क्रमपरिवर्तन ऑप्टिकल एंटीपोड सूत्र की ओर जाता है:

4. ड्राइंग के प्लेन में 90 घुमाने से फॉर्मूला एक एंटीपोड में बदल जाता है।
5. किन्हीं तीन प्रतिस्थापनों को दक्षिणावर्त या वामावर्त घुमाने से सूत्र का स्टीरियोकेमिकल अर्थ नहीं बदलता है:
 6. प्रक्षेपण सूत्र चित्र के तल से नहीं निकाले जा सकते।
6. प्रक्षेपण सूत्र चित्र के तल से नहीं निकाले जा सकते।
कार्बनिक यौगिकों में ऑप्टिकल गतिविधि होती है, जिसके अणुओं में अन्य परमाणु भी चिरल केंद्र होते हैं, उदाहरण के लिए, सिलिकॉन, फास्फोरस, नाइट्रोजन और सल्फर।
कई असममित कार्बन वाले यौगिक मौजूद हैं डायस्टेरोमर्स , अर्थात। स्थानिक आइसोमर्स जो एक दूसरे के साथ ऑप्टिकल एंटीपोड नहीं बनाते हैं।
डायस्टेरोमर्स न केवल ऑप्टिकल रोटेशन में, बल्कि अन्य सभी भौतिक स्थिरांक में भी एक दूसरे से भिन्न होते हैं: उनके अलग-अलग गलनांक और क्वथनांक, अलग-अलग घुलनशीलता आदि होते हैं।
स्थानिक आइसोमर्स की संख्या फिशर सूत्र N=2 n द्वारा निर्धारित की जाती है, जहां n असममित कार्बन परमाणुओं की संख्या है। कुछ संरचनाओं में दिखाई देने वाली आंशिक समरूपता के कारण स्टीरियोइसोमर्स की संख्या घट सकती है। वैकल्पिक रूप से निष्क्रिय डायस्टेरोमर्स कहलाते हैं मुझ-रूप।
ऑप्टिकल आइसोमर्स का नामकरण:
ए) डी-, एल- नामकरण
एक आइसोमर की डी- या एल-श्रृंखला को निर्धारित करने के लिए, कॉन्फ़िगरेशन (असममित कार्बन परमाणु पर ओएच समूह की स्थिति) की तुलना ग्लिसराल्डिहाइड (ग्लिसरॉल कुंजी) के एनेंटिओमर्स के विन्यास से की जाती है:

एल-ग्लिसराल्डिहाइड डी-ग्लिसराल्डिहाइड
डी-, एल-नामकरण का उपयोग वर्तमान में वैकल्पिक रूप से सक्रिय पदार्थों के तीन वर्गों तक सीमित है: कार्बोहाइड्रेट, अमीनो एसिड और हाइड्रॉक्सी एसिड।
बी) आर -, एस-नामकरण (कान, इंगोल्ड और प्रीलॉग का नामकरण)
ऑप्टिकल आइसोमर के आर (दाएं) - या एस (बाएं) - विन्यास को निर्धारित करने के लिए, असममित कार्बन परमाणु के चारों ओर टेट्राहेड्रॉन (स्टीरियोकेमिकल फॉर्मूला) में प्रतिस्थापन की व्यवस्था करना आवश्यक है ताकि सबसे कम प्रतिस्थापन (आमतौर पर हाइड्रोजन) हो दिशा "पर्यवेक्षक से"। यदि वरिष्ठ से मध्य और कनिष्ठ से वरिष्ठता में अन्य तीन प्रतिस्थापनों का संक्रमण दक्षिणावर्त होता है, तो यह आर-आइसोमर है (वरिष्ठता में गिरावट हाथ की गति के साथ मेल खाती है जब अक्षर आर के ऊपरी भाग को लिखते हैं)। यदि संक्रमण वामावर्त होता है - यह S . है - आइसोमर (पत्र एस के ऊपरी भाग को लिखते समय वरिष्ठता में गिरावट हाथ की गति के साथ मेल खाती है)।
प्रक्षेपण सूत्र द्वारा ऑप्टिकल आइसोमर के आर- या एस-कॉन्फ़िगरेशन को निर्धारित करने के लिए, प्रतिस्थापनों को क्रमपरिवर्तन की एक समान संख्या से व्यवस्थित करना आवश्यक है ताकि उनमें से सबसे छोटा प्रक्षेपण के निचले भाग में हो। दक्षिणावर्त शेष तीन प्रतिस्थापनों की वरिष्ठता में गिरावट आर-कॉन्फ़िगरेशन से मेल खाती है, वामावर्त - एस-कॉन्फ़िगरेशन के लिए।
प्रकाशिक समावयवी निम्नलिखित विधियों द्वारा प्राप्त किए जाते हैं:
a) वैकल्पिक रूप से सक्रिय यौगिकों, जैसे प्रोटीन और अमीनो एसिड, कार्बोहाइड्रेट, कई हाइड्रॉक्सी एसिड (टार्टरिक, मैलिक, मैंडेलिक), टेरपीन हाइड्रोकार्बन, टेरपीन अल्कोहल और केटोन्स, स्टेरॉयड, अल्कलॉइड आदि से युक्त प्राकृतिक सामग्री से अलगाव।
बी) रेसमेट्स की दरार;
ग) असममित संश्लेषण;
डी) वैकल्पिक रूप से सक्रिय पदार्थों का जैव रासायनिक उत्पादन।
क्या आप जानते हैं कि
समरूपता की घटना (ग्रीक से - मैंमुसीबत का इशारा - अलग और मेरोस - शेयर, भाग) 1823 में खोला गया था। जे। लिबिग और एफ। वोहलर दो अकार्बनिक एसिड के लवण के उदाहरण पर: साइनिक एच-ओ-सी≡एन और फुलमिनेंट एच-ओ-एन = सी।
1830 में, जे. डुमास ने समावयवता की अवधारणा को कार्बनिक यौगिकों तक विस्तारित किया।
1831 में कार्बनिक यौगिकों के लिए "आइसोमर" शब्द जे. बर्जेलियस द्वारा प्रस्तावित किया गया था।
प्राकृतिक यौगिकों के स्टीरियोइसोमर्स को विभिन्न जैविक गतिविधियों (एमिनो एसिड, कार्बोहाइड्रेट, एल्कलॉइड, हार्मोन, फेरोमोन, प्राकृतिक मूल के औषधीय पदार्थ, आदि) की विशेषता है।
परिचय
समरूपता (यूनानी isos - वही, meros - part) - रसायन विज्ञान में सबसे महत्वपूर्ण अवधारणाओं में से एक, मुख्य रूप से कार्बनिक में। पदार्थों में एक ही संरचना और आणविक भार हो सकते हैं, लेकिन विभिन्न संरचनाएं और यौगिक जिनमें समान तत्व समान मात्रा में होते हैं, लेकिन परमाणुओं या परमाणुओं के समूहों की स्थानिक व्यवस्था में भिन्न होते हैं, आइसोमर कहलाते हैं। आइसोमेरिज्म एक कारण है कि कार्बनिक यौगिक इतने असंख्य और विविध हैं।
समरूपता की खोज का इतिहास
आइसोमेरिज्म की खोज सबसे पहले 1823 में जे. लिबिग ने की थी, जिन्होंने पाया कि फुलमिनेंट और आइसोसायनिक एसिड के सिल्वर सॉल्ट: Ag-O-N=C और Ag-N=C=O की संरचना समान है, लेकिन अलग-अलग गुण हैं। शब्द "आइसोमेरिज्म" को 1830 में आई. बर्जेलियस द्वारा पेश किया गया था, जिन्होंने सुझाव दिया था कि एक ही संरचना के यौगिकों के गुणों में अंतर इस तथ्य के कारण उत्पन्न होता है कि अणु में परमाणुओं को एक असमान क्रम में व्यवस्थित किया जाता है। ए.एम. बटलरोव (1860 के दशक) द्वारा रासायनिक संरचना के सिद्धांत के निर्माण के बाद अंतत: समावयवता के बारे में विचार बनाए गए। समावयवता की सही व्याख्या 19वीं शताब्दी के दूसरे भाग में ही प्राप्त हुई थी। ए.एम. की रासायनिक संरचना के सिद्धांत पर आधारित है। बटलरोव (संरचनात्मक समरूपता) और Ya.G. का स्टीरियोकेमिकल सिद्धांत। वैंट हॉफ (स्थानिक समरूपता)। इस सिद्धांत के प्रावधानों के आधार पर, उन्होंने सुझाव दिया कि चार अलग-अलग ब्यूटेनॉल होने चाहिए (चित्र 1)। जब तक सिद्धांत बनाया गया था, तब तक केवल एक ब्यूटेनॉल (सीएच 3) 2 सीएचसीएच 2 ओएच, पौधों की सामग्री से प्राप्त किया गया था।
चित्र एक। OH समूह की विभिन्न स्थितियाँ - ब्यूटेनॉल अणु में।
बुटानॉल के सभी आइसोमर्स के बाद के संश्लेषण और उनके गुणों का निर्धारण सिद्धांत की एक ठोस पुष्टि बन गया।
आधुनिक परिभाषा के अनुसार, एक ही संरचना के दो यौगिकों को आइसोमर माना जाता है यदि उनके अणुओं को अंतरिक्ष में नहीं जोड़ा जा सकता है ताकि वे पूरी तरह से मेल खाते हों। संयोजन, एक नियम के रूप में, मानसिक रूप से किया जाता है, जटिल मामलों में, स्थानिक मॉडल या गणना विधियों का उपयोग किया जाता है।
समरूपता के प्रकार
समरूपता में, दो मुख्य प्रकारों को प्रतिष्ठित किया जा सकता है: संरचनात्मक समरूपता और स्थानिक समरूपता, या, जैसा कि इसे स्टीरियोइसोमेरिज्म भी कहा जाता है।
बदले में, संरचनात्मक में विभाजित है:
कार्बन श्रृंखला का समरूपता (कार्बन कंकाल)
संयोजकता समावयवता
कार्यात्मक समूह समरूपता
स्थिति समरूपता।
स्थानिक समरूपता (स्टीरियोइसोमेरिज्म) में विभाजित है:
डायस्टेरोमेरिज्म (सीआईएस, ट्रांस - आइसोमेरिज्म)
enantiomerism (ऑप्टिकल आइसोमेरिज्म)।
संरचनात्मक समरूपता
यह, एक नियम के रूप में, हाइड्रोकार्बन कंकाल की संरचना में अंतर या कार्यात्मक समूहों या कई बांडों की असमान व्यवस्था के कारण होता है।
हाइड्रोकार्बन कंकाल का समरूपता
एक से तीन कार्बन परमाणुओं (मीथेन, ईथेन, प्रोपेन) से युक्त संतृप्त हाइड्रोकार्बन में आइसोमर्स नहीं होते हैं। चार कार्बन परमाणुओं सी 4 एच 10 (ब्यूटेन) के साथ एक यौगिक के लिए, दो आइसोमर संभव हैं, पेंटेन सी 5 एच 12 के लिए - तीन आइसोमर्स, हेक्सेन सी 6 एच 14 - पांच (छवि 2) के लिए:

रेखा चित्र नम्बर 2।
हाइड्रोकार्बन अणु में कार्बन परमाणुओं की संख्या में वृद्धि के साथ, संभावित आइसोमर्स की संख्या नाटकीय रूप से बढ़ जाती है। सी 7 एच 16 हेप्टेन के लिए, सी 14 एच 30 हाइड्रोकार्बन के लिए नौ आइसोमर हैं - 1885 आइसोमर्स, सी 20 एच 42 हाइड्रोकार्बन के लिए - 366,000 से अधिक। जटिल मामलों में, यह सवाल कि क्या दो यौगिक आइसोमर्स हैं, विभिन्न घुमावों का उपयोग करके हल किया जाता है वैलेंस बॉन्ड (सरल बॉन्ड इसकी अनुमति देते हैं, जो कुछ हद तक उनके भौतिक गुणों से मेल खाते हैं)। अणु के अलग-अलग टुकड़ों को स्थानांतरित करने के बाद (बंधों को तोड़े बिना), एक अणु दूसरे पर आरोपित होता है। यदि दो अणु बिल्कुल समान हैं, तो ये समावयवी नहीं हैं, बल्कि एक ही यौगिक हैं। कंकाल की संरचना में भिन्न आइसोमर्स में आमतौर पर अलग-अलग भौतिक गुण होते हैं (गलनांक, क्वथनांक, आदि), जो एक को दूसरे से अलग करना संभव बनाता है। इस प्रकार का समावयवता ऐरोमैटिक हाइड्रोकार्बन में भी पाया जाता है (चित्र 4)।