एटीएफ का एरोबिक संश्लेषण। श्वसन श्रृंखला और एटीपी संश्लेषण एटीपी सिंथेटेज़ माइटोकॉन्ड्रिया में स्थित है
एडीपी + पीओ 4 3- + इ⇔एटीपी
एटीपी का उपयोग कोशिकाओं द्वारा कई सेलुलर प्रक्रियाओं में ऊर्जा स्रोत के रूप में किया जाता है। वही प्रतिक्रिया विपरीत दिशा में भी जा सकती है, जब एटीपी एक विशेष उत्प्रेरक प्रोटीन द्वारा टूट कर वापस एडीपी और फॉस्फेट में बदल जाता है, जिससे ऊर्जा निकलती है।
एटीपी सिंथेज़ में दो तंत्र होते हैं। पहला, F0, कोशिका झिल्ली में स्थित एक विद्युत मोटर है और कोशिका झिल्ली के विपरीत पक्षों पर संभावित अंतर में संग्रहीत ऊर्जा को परिवर्तित करता है। लिपिड झिल्ली इस इलेक्ट्रोकेमिकल "बैटरी" में एक इन्सुलेटर के रूप में कार्य करती है: आयन इसके माध्यम से नहीं गुजरते हैं। संभावित अंतर अन्य जटिल तंत्रों द्वारा अंततः ऑक्सीजन में चीनी के "जलने" से पैदा होता है। हाइड्रोजन आयन H+ को "इनटेक मैनिफोल्ड" में खींचा जाता है और रोटर के प्रोटीन लोब से जोड़ दिया जाता है। इलेक्ट्रोस्टैटिक बलों के कारण रोटर घूमता है, और मोटर के "एग्जॉस्ट मैनिफोल्ड" तक पहुंचने वाले लोब को उत्प्रेरक प्रोटीन द्वारा आयन से मुक्त किया जाता है, और यह आयन सेल में गिर जाता है, फिर से इलेक्ट्रोस्टैटिक बलों के कारण क्षमता को बराबर करने की प्रवृत्ति होती है झिल्ली के दोनों ओर. इस प्रकार, विद्युत ऊर्जा को पहले रोटर से जुड़े आणविक शाफ्ट के घूर्णन की यांत्रिक ऊर्जा में परिवर्तित किया जाता है और कोशिका में गहराई तक जाकर, संश्लेषण तंत्र, F1 में परिवर्तित किया जाता है।
यांत्रिक-रासायनिक रिएक्टर F1 में तीन प्रोटीन लोब होते हैं, जिनमें से प्रत्येक में दो प्रोटीन अणु होते हैं (इन्हें α-F1 और β-F1 कहा जाता है, और शाफ्ट एक अणु से बना होता है, जिसे γ-F1 दर्शाया जाता है)। प्रत्येक लोब आपसी अंतरपरमाणु आकर्षण के कारण दो स्थिर स्थानिक विन्यास ग्रहण कर सकता है - ठीक उसी तरह जैसे एक साधारण दीवार स्विच खुद को दो स्थिर स्थितियों में पाता है, हालांकि मध्यवर्ती स्थिति अस्थिर होती है। हालाँकि, इनमें से एक स्थिति में उच्च ऊर्जा होती है। घूमने वाले γ-शाफ्ट की विषमता के कारण अणु उच्च ऊर्जा विन्यास में स्थानांतरित हो जाते हैं, जैसे कि उस पर एक "कैम" लगा हो।
जब ADP और फॉस्फेट आयन αβ कॉम्प्लेक्स में शामिल होते हैं, तो संतुलन बाधित हो जाता है, और अणु, संग्रहीत ऊर्जा वाले स्प्रिंग की तरह, कम ऊर्जा वाली स्थिति में पहुंच जाता है, और संग्रहीत ऊर्जा ADP और फॉस्फेट आयन को एक साथ लाने पर खर्च होती है। , जिसके परिणामस्वरूप वे एक एटीपी अणु में संयोजित होते हैं, अंततः ऊर्जा की इस आपूर्ति को दूर ले जाते हैं।
तंत्र के घूर्णन को माइक्रोस्कोप के माध्यम से देखा जा सकता है यदि एक विशेष रूप से निर्मित लंबी चमकदार (फ्लोरोसेंट) रॉड अणु रोटर से F0 पर जुड़ा हुआ है। फिल्म के अंत में, आप मासासुके योशिदा के इस अद्भुत प्रयोग का पुनर्निर्माण और रोटर के घूर्णन को दर्शाने वाला डेटा सम्मिलित देख सकते हैं।
दिलचस्प बात यह है कि रोटर के निचले सिरे पर एक और प्रोटीन, δ-F1 होता है, जो प्रतिक्रिया के लिए प्रारंभिक अभिकर्मक ADP की उपस्थिति में कॉन्फ़िगरेशन भी बदल सकता है। जब रिएक्टर के चारों ओर पर्याप्त एडीपी नहीं होता है, तो यह प्रोटीन आकार बदलता है और रोटर को जाम कर देता है ताकि विद्युत रासायनिक ऊर्जा बर्बाद न हो, क्योंकि रुके हुए रोटर के माध्यम से एच + आयनों की आवाजाही असंभव है। हाँ, प्रकृति ने भी सेलुलर बिजली बचाने के बारे में "सोचा"!
एटीपी सिनेज़ के कार्य के बारे में अधिक जानकारी यहां पाई जा सकती है
एटीपी सिंथेज़ में दो तंत्र होते हैं। पहला, F0, कोशिका झिल्ली में स्थित एक विद्युत मोटर है और कोशिका झिल्ली के विपरीत पक्षों पर संभावित अंतर में संग्रहीत ऊर्जा को परिवर्तित करता है। लिपिड झिल्ली इस इलेक्ट्रोकेमिकल "बैटरी" में एक इन्सुलेटर के रूप में कार्य करती है: आयन इसके माध्यम से नहीं गुजरते हैं। संभावित अंतर अन्य जटिल तंत्रों द्वारा अंततः ऑक्सीजन में चीनी के "जलने" से पैदा होता है। हाइड्रोजन आयन H+ को "इनटेक मैनिफोल्ड" में खींचा जाता है और रोटर के प्रोटीन लोब से जोड़ दिया जाता है। इलेक्ट्रोस्टैटिक बलों के कारण रोटर घूमता है, और मोटर के "एग्जॉस्ट मैनिफोल्ड" तक पहुंचने वाले लोब को उत्प्रेरक प्रोटीन द्वारा आयन से मुक्त किया जाता है, और यह आयन सेल में गिर जाता है, फिर से इलेक्ट्रोस्टैटिक बलों के कारण क्षमता को बराबर करने की प्रवृत्ति होती है झिल्ली के दोनों ओर. इस प्रकार, विद्युत ऊर्जा को पहले रोटर से जुड़े आणविक शाफ्ट के घूर्णन की यांत्रिक ऊर्जा में परिवर्तित किया जाता है और कोशिका में गहराई तक जाकर, संश्लेषण तंत्र, F1 में परिवर्तित किया जाता है।
यांत्रिक-रासायनिक रिएक्टर F1 में तीन प्रोटीन लोब होते हैं, जिनमें से प्रत्येक में दो प्रोटीन अणु होते हैं (इन्हें α-F1 और β-F1 कहा जाता है, और शाफ्ट एक अणु से बना होता है, जिसे γ-F1 दर्शाया जाता है)। प्रत्येक लोब आपसी अंतरपरमाणु आकर्षण के कारण दो स्थिर स्थानिक विन्यास ग्रहण कर सकता है - ठीक उसी तरह जैसे एक साधारण दीवार स्विच खुद को दो स्थिर स्थितियों में पाता है, हालांकि मध्यवर्ती स्थिति अस्थिर होती है। हालाँकि, इनमें से एक स्थिति में उच्च ऊर्जा होती है। घूमने वाले γ-शाफ्ट की विषमता के कारण अणु उच्च ऊर्जा विन्यास में स्थानांतरित हो जाते हैं, जैसे कि उस पर एक "कैम" लगा हो।
जब ADP और फॉस्फेट आयन αβ कॉम्प्लेक्स में शामिल होते हैं, तो संतुलन बाधित हो जाता है, और अणु, संग्रहीत ऊर्जा वाले स्प्रिंग की तरह, कम ऊर्जा वाली स्थिति में पहुंच जाता है, और संग्रहीत ऊर्जा ADP और फॉस्फेट आयन को एक साथ लाने पर खर्च होती है। , जिसके परिणामस्वरूप वे एक एटीपी अणु में संयोजित होते हैं, अंततः ऊर्जा की इस आपूर्ति को दूर ले जाते हैं।
तंत्र के घूर्णन को माइक्रोस्कोप के माध्यम से देखा जा सकता है यदि एक विशेष रूप से निर्मित लंबी चमकदार (फ्लोरोसेंट) रॉड अणु रोटर से F0 पर जुड़ा हुआ है। फिल्म के बिल्कुल अंत में, आप मासासुके योशिदा के इस अद्भुत प्रयोग का पुनर्निर्माण और रोटर के घूर्णन को दर्शाने वाला डेटा सम्मिलित देख सकते हैं।
दिलचस्प बात यह है कि रोटर के निचले सिरे पर एक और प्रोटीन, δ-F1 होता है, जो प्रतिक्रिया के लिए प्रारंभिक अभिकर्मक ADP की उपस्थिति में कॉन्फ़िगरेशन भी बदल सकता है। जब रिएक्टर के चारों ओर पर्याप्त एडीपी नहीं होता है, तो यह प्रोटीन आकार बदलता है और रोटर को जाम कर देता है ताकि विद्युत रासायनिक ऊर्जा बर्बाद न हो, क्योंकि रुके हुए रोटर के माध्यम से एच + आयनों की आवाजाही असंभव है।
2.2. घटते समकक्षों के प्रवाह का विनियमन
यदि दो ऑक्सीकरण मार्ग: मुक्त और ऊर्जावान रूप से संयुग्मित, एक ही कोशिका में सह-अस्तित्व में हैं, तो समस्या उत्पन्न होती है कि थर्मोडायनामिक रूप से अधिक अनुकूल एक के साथ सभी कम करने वाले समकक्षों के उपयोग को कैसे रोका जाए। बिना किसी संदेह के, चयापचय प्रक्रियाओं का स्थानिक विभेदन (विभागीकरण) इस समस्या को हल करने में अग्रणी भूमिका निभाता है। उदाहरण के लिए, मुख्य सब्सट्रेट्स के डिहाइड्रोजनेज को मैट्रिक्स में स्थानीयकृत किया जाता है, ताकि श्वसन श्रृंखला को खिलाने वाले कम करने वाले समकक्ष सीधे माइटोकॉन्ड्रिया के अंदर बनते हैं और इसलिए बाहरी मुक्त ऑक्सीकरण प्रणालियों के लिए स्वयं पहुंच योग्य नहीं होते हैं। इसके अलावा, आंतरिक माइटोकॉन्ड्रियल झिल्ली में कई एसीएच-निर्भर ट्रांसपोर्टर होते हैं जो उन सब्सट्रेट्स के मैट्रिक्स में संचय के लिए जिम्मेदार होते हैं जिनके डिहाइड्रोजनेज न केवल माइटोकॉन्ड्रिया में, बल्कि साइटोसोल में भी मौजूद होते हैं। यदि किसी दिए गए सब्सट्रेट का डिहाइड्रोजनेज विशेष रूप से साइटोसोल में स्थानीयकृत होता है, तो साइटोसोल से मैट्रिक्स तक कम करने वाले समकक्षों को स्थानांतरित करने के लिए विशेष शटल तंत्र का उपयोग किया जाता है।
मैलेट-एस्पार्टेट-ग्लूटामेट शटल।इस प्रणाली की क्रिया से NAD+ मैट्रिक्स के माध्यम से एक्स्ट्रामाइटोकॉन्ड्रियल NADH का ऑक्सीकरण होता है। इस प्रक्रिया में आंतरिक माइटोकॉन्ड्रियल झिल्ली के दोनों किनारों पर स्थित दो एंजाइम शामिल होते हैं, अर्थात् मैलेट डिहाइड्रोजनेज और एस्पार्टेट: ग्लूटामेट एमिनोट्रांस्फरेज़। इसके अलावा, दो ट्रांसपोर्टरों की आवश्यकता होती है: डाइकारबॉक्सिलिक एसिड एंटीपोर्टर और ग्लूटामेट/एस्पार्टेट एंटीपोर्टर। उत्तरार्द्ध AjiH की ऊर्जा का उपयोग करता है, क्योंकि यह एस्पार्टेट 2 -/ (ग्लूटामेट 2_ +H +) के आदान-प्रदान को उत्प्रेरित करता है। परिणामस्वरूप, NADH+nar से NAD+in में हाइड्राइड आयन का स्थानांतरण साइटोसोल से मैट्रिक्स तक एक H+ आयन की गति के साथ जुड़ा होता है।
एक अन्य शटल तंत्र दो ग्लिसरोफॉस्फेट डिहाइड्रोजनेज का उपयोग करता है: साइटोसोलिक, एनएडी-निर्भर, और माइटोकॉन्ड्रियल, कम करना KoQएनएडी की भागीदारी के बिना. शटल प्रणालियाँ ऊतक विशिष्ट होती हैं। उदाहरण के लिए, मैलेट शटल यकृत में अत्यधिक सक्रिय है लेकिन हृदय में अनुपस्थित है, जहां माइटोकॉन्ड्रिया में डाइकारबॉक्साइलेट एंटीपोर्टर की कमी होती है। ग्लिसरोफॉस्फेट शटलथायराइड हार्मोन द्वारा तेजी से सक्रिय किया जाता है।
ऑक्सीडेटिव चयापचय के स्थानिक पृथक्करण का एक और उदाहरण हो सकता है पेरोक्सीसोम्स।ये अंगक एक झिल्ली से घिरे होते हैं जिसकी पारगम्यता बाहरी माइटोकॉन्ड्रियल झिल्ली के समान होती है। यह प्रोटीन के लिए पारगम्य नहीं है, लेकिन कम आणविक भार वाले पदार्थों को आसानी से गुजरने देता है। पेरोक्सीसोम द्वारा ऑक्सीजन का अवशोषण यूरेट ऑक्सीडेज, डी-एमिनो एसिड ऑक्सीडेज और ए-हाइड्रॉक्सी एसिड ऑक्सीडेज की क्रिया के कारण होता है। पेरोक्सीसोम ऑक्सीडेज माइटोकॉन्ड्रियल युग्मित श्वसन एंजाइमों के साथ प्रतिस्पर्धा नहीं करते हैं, क्योंकि इन ऑक्सीडेज के सब्सट्रेट एनएडी (पी) और श्वसन श्रृंखला की भागीदारी के बिना ऑक्सीकृत होते हैं। प्रतिक्रिया का विषाक्त उत्पाद - हाइड्रोजन पेरोक्साइड - कैटालेज़ द्वारा पेरोक्सीसोम के अंदर तुरंत विघटित हो जाता है, जो इन अंगों में सबसे प्रचुर प्रोटीन है।
3.1. एच+-पाइरोफॉस्फेट सिंथेज़
1966 में, एम. बाल्ज़वेस्की और सहकर्मियों ने क्रोमैटोफोरस द्वारा अकार्बनिक पायरोफॉस्फेट के निर्माण का वर्णन किया रोडोस्पिरिलम रूब्रमप्रकाश के प्रभाव में. बाद में यह पाया गया कि अंधेरे में, एटीपी की तरह पायरोफॉस्फेट, क्रोमैटोफोर झिल्ली को सक्रिय करता है। लेखक के समूह में प्रयोगों से पता चला है कि पाइरोफॉस्फेट के हाइड्रोलिसिस से क्रोमैटोफोर्स की झिल्ली पर एजीआर उत्पन्न होता है, साथ ही शुद्ध पायरोफॉस्फेट युक्त प्रोटीओलिपोसोम भी उत्पन्न होता है। आरएच. रूब्रम.फिर आर. निरेन और एम. बाल्ज़वेस्की ने पायरोफॉस्फेटेज़ और एच+-एटीपी सिंथेज़ युक्त प्रोटीओलिपोसोम द्वारा पायरोफॉस्फेट के हाइड्रोलिसिस की ऊर्जा के कारण एटीपी के संश्लेषण की सूचना दी। आरएच. रूब्रम.प्रोटोनोफोर्स ने इस प्रक्रिया को अवरुद्ध कर दिया। क्रोमैटोफोरस में, पाइरोफॉस्फेट गतिविधि का प्रोटॉन नियंत्रण दिखाया गया था, जो एलपीएच के नष्ट होने पर आठ गुना बढ़ गया था।
ऊपर सूचीबद्ध डेटा यह निष्कर्ष निकालने के लिए पर्याप्त लगता है आरएच क्रोमैटोफोरस की झिल्ली पाइरोफॉस्फेटेज़। रुब्रटिम में H+ पंप गतिविधि है,डीसी और पाइरोफॉस्फेट के बीच ऊर्जा के प्रतिवर्ती अंतररूपांतरण को उत्प्रेरित करना। इसलिए, इस एंजाइम को इस प्रकार परिभाषित किया जा सकता है एच+-पाइरोफॉस्फेट सिंथेज़।
एंजाइम की क्रिया का तंत्र और उसके आणविक गुण अस्पष्ट रहते हैं। केवल अवरोधकों का एक सेट ज्ञात है जो एंजाइम की झिल्ली और घुलनशील दोनों रूपों की पाइरोफॉस्फेट गतिविधि को दबा देता है। ये हैं फ्लोराइड, इमिडोडिफॉस्फेट, एन-एथिलमेलिमाइड और एंटीबायोटिक डियो-9। ओलिगोमाइसिन एंजाइम को प्रभावित नहीं करता है। डीसीसीडी क्रोमैटोफोरस में पाइरोफॉस्फेट गतिविधि को कम करता है, लेकिन समाधान या प्रोटियोलिपोसोम में नहीं। प्रोटीओलिपोसोम द्वारा ए-एफ का निर्माण डीसीसीडी के प्रति संवेदनशील है।
ऐसा प्रतीत होता है कि कोशिकाओं में H+-पाइरोफॉस्फेट सिंथेज़ का कार्य आरएच. रूब्रमप्रकाश ऊर्जा (या) के कारण पायरोफॉस्फेट का संश्लेषण होना चाहिए
श्वसन) या पाइरोफॉस्फेट के जल-अपघटन के कारण AcH का निर्माण। हालाँकि, पहले मामले में, गठित पाइरोफॉस्फेट का आगे का भाग्य, जो सामान्य कोशिकाओं में घुलनशील पाइरोफॉस्फेट द्वारा विखंडित होता है, स्पष्ट नहीं है। उत्तरार्द्ध पायरोफॉस्फेट की सांद्रता को निम्न स्तर पर रखने के लिए आवश्यक है और इस तरह पायरोफॉस्फेट के निर्माण के साथ एटीपी-निर्भर जैवसंश्लेषण को उत्तेजित करता है। हालाँकि, इस नियम के अपवाद हैं कि पायरोफॉस्फेट घुलनशील पायरोफॉस्फेटस द्वारा तुरंत टूट जाता है। कुछ बैक्टीरिया में पायरोफॉस्फेट की ऊर्जा का उपयोग करने वाली कई सिंथेटिक प्रक्रियाओं का वर्णन किया गया है। शायद, आरएच. रूब्रमविशेष रूप से सूक्ष्मजीवों की इसी श्रेणी से संबंधित है। किसी भी स्थिति में, H+-पाइरोफॉस्फेट सिंथेज़ आरएच. रूब्रमएक महत्वपूर्ण जैविक कार्य होना चाहिए। क्रोमैटोफोर्स में इसकी गतिविधि बहुत अधिक है और एच + -एटीपी सिंथेज़ की तुलना में है।
पौधों की कोशिकाओं में पायरोफॉस्फेट की अप्रत्याशित रूप से उच्च सांद्रता पाई गई। पौधों में, H+-पाइरोफॉस्फेटेज़ टोनोप्लास्ट और गोल्गी तंत्र की झिल्लियों में पाया जाता है।
3.2. जीवाणुओं में जीवाणुओं में प्रोटॉन क्षमता का नियंत्रण
जैसा कि पहले ही उल्लेख किया गया है, कई जीवाणुओं में समानांतर इलेक्ट्रॉन परिवहन मार्ग होते हैं, जिनमें से कुछ में ऊर्जा भंडारण शामिल होता है, जबकि अन्य में नहीं। इसके अलावा, मुक्त और संयुग्म ऑक्सीकरण को क्रमिक रूप से एक ही श्वसन श्रृंखला में शामिल किया जा सकता है। बैक्टीरिया के संबंध में "लाभकारी अनयुग्मन" की समस्या का कभी अध्ययन नहीं किया गया है।
स्व-नियमन के सिद्धांत के आधार पर उच्च डीसीएन बनाए रखने वाले तंत्र का एक दिलचस्प उदाहरण गतिशील बैक्टीरिया के प्रयोगों में सामने आया था। यह दिखाया गया है कि डीसीएन में कृत्रिम रूप से प्रेरित परिवर्तनों को जीवाणु एक संकेत के रूप में मानता है जो इसके आंदोलन को नियंत्रित करता है। इस प्रकार, एक अनकप्लर का जुड़ना या ऑक्सीजन की कमी एक विकर्षक संकेत के रूप में कार्य करती है, जिससे जीवाणु की गति की दिशा में परिवर्तन होता है। तदनुसार, O2 का योग रैखिक गति के लिए अनुकूल एक आकर्षक उत्तेजना बन जाता है। यह देखा गया कि बैक्टीरिया (एयरोटैक्सिस) के व्यवहार पर ऑक्सीजन का प्रभाव केवल उन मामलों में प्रकट होता है जहां माध्यम में O2 की सांद्रता Dn को प्रभावित करती है।
इन आंकड़ों का सबसे सरल स्पष्टीकरण यह है जीवाणु एक उपकरण है जो मापता है
प्रोटॉन क्षमता और फ़्लैगेलर मोटर को संबंधित सिग्नल भेजता है,इस तरह से विनियमनफ्लैगेलम के घूमने की दिशा: यदि Dp,H घटता है तो दिशा विपरीत दिशा में बदल जाती है, और बढ़ने पर अपरिवर्तित रहती है। परिणामस्वरूप, कोशिका वहां चली जाती है जहां वह उच्च डीपी,एच बनाए रख सकती है। इस प्रकार का एक काल्पनिक तंत्र, जिसे लेखक ने कहा है प्रोटोमीटर,आपको कई लाभकारी और प्रतिकूल प्रभावों को एकीकृत करने की अनुमति देता है जो झिल्ली की ऊर्जावान स्थिति को प्रभावित करते हैं।
एक तंत्र का वर्णन किया गया है जो क्लोरोप्लास्ट में दो फोटोसिस्टम के काम का समन्वय करता है और इस तरह डॉ, एच और एनएडीपीएच के उत्पादन को अनुकूलित करता है। यदि फोटोसिस्टम II बहुत तेजी से काम करता है, तो इससे रेडॉक्स ट्रांसपोर्टर की कमी हो जाती है (संभवतः)। पी क्यू),दो फोटोसिस्टम के बीच जुड़ा हुआ है। यह प्रभाव किसी तरह से प्रोटीन काइनेज को सक्रिय करता है, जो एंटीना के क्लोरोफिल को ले जाने वाले प्रोटीन को फॉस्फोराइलेट करता है। नामित प्रोटीन अपनी गैर-फॉस्फोराइलेटेड अवस्था में मुख्य रूप से थायलाकोइड्स में स्थानीयकृत होता है, जो ग्रेना में पैक होता है। फॉस्फोराइलेशन एंटीना प्रोटीन के नकारात्मक चार्ज को बढ़ाता है, जो थायलाकोइड्स से स्ट्रोमल झिल्ली में फैलता है, जहां फोटोसिस्टम I आमतौर पर स्थानीयकृत होता है, परिणामस्वरूप, फोटोसिस्टम I को फोटोसिस्टम II की तुलना में अधिक एंटीना क्लोरोफिल और इसलिए अधिक फोटॉन प्राप्त होता है। फोटोसिस्टम I के सक्रिय होने से PQH2 का ऑक्सीकरण होता है, और इसलिए प्रोटीन काइनेज का निषेध होता है। एक लगातार कार्य करने वाला प्रोटीन फॉस्फेटस एंटीना प्रोटीन को डिफॉस्फोराइलेट करता है और थायलाकोइड्स से स्ट्रोमल लैमेला में इसके आगे के रिसाव को रोकता है।
5.1. आसमाटिक कार्य
(Na+, मेटाबोलाइट)-समर्थक। शराब-सहिष्णु वी. एल्गिनो-लिटिकस,संचय के लिए जिम्मेदार Na+-NADH-क्विनोन रिडक्टेस, (Na+, मेटाबोलाइट)-समर्थक होना 19 अमीनो एसिड और सुक्रोज।
यह भी दिखाया गया है कि कोशिकाओं में K+ का संचय होता है वी. एल्गिनोलिटिकसक्षारीय pH पर इसे Na + -NADH-क्विनोन रिडक्टेस द्वारा उत्पन्न ऊर्जा Aif> द्वारा बनाए रखा जाता है। कई रिपोर्टों में क्षारीय बेसिली में मेटाबोलाइट्स के Na+-निर्भर संचय का वर्णन किया गया है। हालाँकि, यह स्पष्ट नहीं है कि ये क्षारीय पदार्थ Ajj,Na कैसे बनाते हैं।
NaCl की कम से मध्यम सांद्रता में रहने वाले न्यूट्रोफिलिक बैक्टीरिया आमतौर पर आयातित आयन के रूप में Na+ के बजाय H+ का उपयोग करते हैं। हालाँकि, इस नियम के ज्ञात अपवाद भी हैं। इसलिए, PROLINE Na+ के साथ कोशिकाओं में पहुँचाया जाता है माइकोबैक्टीरियम फ़्ली, साल्मोनेला टाइफिमुरियमऔर ई कोलाई।
मेटाबोलाइट आयात का एक दिलचस्प "द्वैतवादी" तंत्र द्वारा वर्णित है ई कोलाई।यह पता चला कि संचय के दौरान यह जीवाणु वैकल्पिक रूप से संयुग्मी धनायन के रूप में H+ या Na+ का उपयोग करता है melibioses.बैक्टीरिया द्वारा साइट्रेट का ग्रहण क्लेबसिएला निमोनिया किया जाता हैएक ट्रांसपोर्टर जो साइट्रेट 3-, 2Na + और 2H+ का सिंपोर्ट प्रदान करता है। इसका मतलब यह है कि प्रक्रिया की प्रेरक शक्ति Ar|e, pNa और DrN होनी चाहिए।
ए. ब्रॉडी और सहकर्मी (Na+, प्रोलाइन) सिम-पोर्टर को अलग करने में सफल रहे एम. फली,जो 20 केडीए प्रोटीन निकला। शुद्ध सिम्पोर्टर को फॉस्फोलिपिड्स के साथ पुनर्गठित किया गया था। परिणामी प्रोटियोलिपोसोम्स ने K + आयनों के प्रसार से बने Agr के कारण प्रोलाइन का परिवहन किया। प्रोलाइन का संचय प्रोटोनोफोरस द्वारा बाधित हुआ, जिसने डीजी को कम किया, साथ ही सल्फहाइड्रील अभिकर्मकों द्वारा भी।
हेलोफिलिक से (Na+, acpartate) सिंपोर्टर का आंशिक शुद्धिकरण और पुनर्निर्माण हेलोबैक्टीरियम हेलोबियम.बिल्कुल भी समुद्री और हेलोफिलिक सूक्ष्मजीव, जैसे क्षारीय सूक्ष्मजीव, आमतौर पर आयातित आयन के रूप में H+ के बजाय Na+ का उपयोग करते हैं।यह उच्च जानवरों की कोशिकाओं की बाहरी झिल्ली के लिए भी सच है, जिसे NaCl की उच्च सांद्रता वाले घोल से धोया जाता है। यह परिस्थिति इस राय की वैधता का एक और प्रमाण है कि रक्त "मानव शरीर में समुद्र का एक टुकड़ा है।" Na+/K+-ATOa3a (कुछ मामलों में Na+-ATPase भी) पशु कोशिकाओं के प्लाज़्मालेम्मा पर अजिना जनरेटर के रूप में कार्य करता है। गठित अजीना का उपयोग विभिन्न ट्रांसपोर्टरों द्वारा किया जाता है जो अमीनो एसिड, शर्करा, फैटी एसिड और अन्य यौगिकों को कोशिका में पहुंचाते हैं। कई (Na+, मेटाबोलाइट) सिंपोर्टर्स को अलग किया जाता है और प्रोटियोलिपोसोम में शामिल किया जाता है।
कुछ जंतु कोशिकाओं की बाहरी झिल्ली में H+-ATPase होता है। (H+, मेटाबोलाइट)-समवाहक भी इन कोशिकाओं में पाए गए।
एडेनोसिन ट्राइफॉस्फोरिक एसिड-एटीपी- किसी भी जीवित कोशिका का एक आवश्यक ऊर्जा घटक। एटीपी भी एक न्यूक्लियोटाइड है जिसमें नाइट्रोजन बेस एडेनिन, चीनी राइबोस और तीन फॉस्फोरिक एसिड अणु अवशेष शामिल हैं। यह एक अस्थिर संरचना है. चयापचय प्रक्रियाओं में, फॉस्फोरिक एसिड अवशेषों को दूसरे और तीसरे फॉस्फोरिक एसिड अवशेषों के बीच ऊर्जा-समृद्ध लेकिन नाजुक बंधन को तोड़कर क्रमिक रूप से अलग किया जाता है। फॉस्फोरिक एसिड के एक अणु के पृथक्करण के साथ लगभग 40 kJ ऊर्जा निकलती है। इस मामले में, एटीपी को एडेनोसिन डिपोस्फोरिक एसिड (एडीपी) में परिवर्तित किया जाता है, और एडीपी से फॉस्फोरिक एसिड अवशेषों के आगे टूटने के साथ, एडेनोसिन मोनोफॉस्फोरिक एसिड (एएमपी) बनता है।
एटीपी की संरचना और एडीपी में इसके रूपांतरण की योजना (टी.ए. कोज़लोवा, वी.एस. Kuchmenko. तालिकाओं में जीव विज्ञान. एम., 2000 )
नतीजतन, एटीपी कोशिका में एक प्रकार का ऊर्जा संचयकर्ता है, जो टूटने पर "डिस्चार्ज" हो जाता है। एटीपी का टूटना प्रोटीन, वसा, कार्बोहाइड्रेट और कोशिकाओं के किसी अन्य महत्वपूर्ण कार्य के संश्लेषण की प्रतिक्रियाओं के दौरान होता है। ये प्रतिक्रियाएं ऊर्जा के अवशोषण के साथ होती हैं, जो पदार्थों के टूटने के दौरान निकाली जाती है।
एटीपी का संश्लेषण होता हैमाइटोकॉन्ड्रिया में कई चरणों में। पहला है तैयारी -प्रत्येक चरण में विशिष्ट एंजाइमों की भागीदारी के साथ, चरणों में आगे बढ़ता है। इस मामले में, जटिल कार्बनिक यौगिक मोनोमर्स में टूट जाते हैं: प्रोटीन अमीनो एसिड में, कार्बोहाइड्रेट ग्लूकोज में, न्यूक्लिक एसिड न्यूक्लियोटाइड में, आदि। इन पदार्थों में बंधनों के टूटने के साथ थोड़ी मात्रा में ऊर्जा निकलती है। परिणामी मोनोमर्स, अन्य एंजाइमों के प्रभाव में, कार्बन डाइऑक्साइड और पानी तक सरल पदार्थों के निर्माण के साथ और अधिक विघटित हो सकते हैं।
योजना कोशिका माइटोकॉन्ड्रिया में एटीपी संश्लेषण
विखंडन की प्रक्रिया में पदार्थों और ऊर्जा के आरेख परिवर्तन के लिए स्पष्टीकरण
चरण I - प्रारंभिक: जटिल कार्बनिक पदार्थ, पाचन एंजाइमों के प्रभाव में, सरल पदार्थों में टूट जाते हैं, और केवल तापीय ऊर्जा निकलती है।
प्रोटीन ->अमीनो एसिड
वसा- >
ग्लिसरॉल और फैटी एसिड
स्टार्च ->ग्लूकोज
चरण II - ग्लाइकोलाइसिस (ऑक्सीजन मुक्त): हाइलोप्लाज्म में किया जाता है, झिल्ली से जुड़ा नहीं; इसमें एंजाइम शामिल होते हैं; ग्लूकोज टूट गया है:
खमीर कवक में, ऑक्सीजन की भागीदारी के बिना एक ग्लूकोज अणु एथिल अल्कोहल और कार्बन डाइऑक्साइड (अल्कोहल किण्वन) में परिवर्तित हो जाता है:
अन्य सूक्ष्मजीवों में, ग्लाइकोलाइसिस के परिणामस्वरूप एसीटोन, एसिटिक एसिड आदि का निर्माण हो सकता है। सभी मामलों में, एक ग्लूकोज अणु के टूटने के साथ दो एटीपी अणुओं का निर्माण होता है। एटीपी अणु में रासायनिक बंधन के रूप में ग्लूकोज के ऑक्सीजन मुक्त टूटने के दौरान, 40% ऊर्जा बरकरार रहती है, और बाकी गर्मी के रूप में नष्ट हो जाती है।
चरण III - हाइड्रोलिसिस (ऑक्सीजन): माइटोकॉन्ड्रिया में किया जाता है, माइटोकॉन्ड्रियल मैट्रिक्स और आंतरिक झिल्ली से जुड़ा होता है, एंजाइम इसमें भाग लेते हैं, लैक्टिक एसिड टूट जाता है: C3H6O3 + 3H20 --> 3CO2+ 12H। CO2 (कार्बन डाइऑक्साइड) माइटोकॉन्ड्रिया से पर्यावरण में छोड़ा जाता है। हाइड्रोजन परमाणु प्रतिक्रियाओं की एक श्रृंखला में शामिल है, जिसका अंतिम परिणाम एटीपी का संश्लेषण है। ये प्रतिक्रियाएँ निम्नलिखित क्रम में होती हैं:
1. हाइड्रोजन परमाणु H, वाहक एंजाइमों की मदद से, माइटोकॉन्ड्रिया की आंतरिक झिल्ली में प्रवेश करता है, जिससे क्राइस्टे बनता है, जहां यह ऑक्सीकृत होता है: H-e--> एच+
2. हाइड्रोजन प्रोटोन एच+(धनायन) वाहकों द्वारा क्रिस्टी झिल्ली की बाहरी सतह तक ले जाया जाता है। यह झिल्ली प्रोटॉन के लिए अभेद्य है, इसलिए वे इंटरमेम्ब्रेन स्पेस में जमा हो जाते हैं, जिससे प्रोटॉन भंडार बनता है।
3. हाइड्रोजन इलेक्ट्रॉन इक्रिस्टे झिल्ली की आंतरिक सतह पर स्थानांतरित हो जाते हैं और एंजाइम ऑक्सीडेज का उपयोग करके तुरंत ऑक्सीजन से जुड़ जाते हैं, जिससे नकारात्मक रूप से चार्ज सक्रिय ऑक्सीजन (आयन) बनता है: O2 + e--> O2-
4. झिल्ली के दोनों किनारों पर धनायन और ऋणायन एक विपरीत आवेशित विद्युत क्षेत्र बनाते हैं, और जब संभावित अंतर 200 mV तक पहुँच जाता है, तो प्रोटॉन चैनल काम करना शुरू कर देता है। यह एटीपी सिंथेटेज़ एंजाइम के अणुओं में होता है, जो क्राइस्टे बनाने वाली आंतरिक झिल्ली में अंतर्निहित होते हैं।
5. हाइड्रोजन प्रोटॉन प्रोटॉन चैनल से होकर गुजरते हैं एच+माइटोकॉन्ड्रिया के अंदर तेजी से ऊर्जा का निर्माण होता है, जिसका अधिकांश भाग एडीपी और पी (एडीपी+पी-->एटीपी), और प्रोटॉन से एटीपी के संश्लेषण में जाता है एच+सक्रिय ऑक्सीजन के साथ परस्पर क्रिया करके पानी और आणविक 02 बनाते हैं:
(4Н++202- -->2Н20+02)
इस प्रकार, O2, जो शरीर की श्वसन प्रक्रिया के दौरान माइटोकॉन्ड्रिया में प्रवेश करता है, हाइड्रोजन प्रोटॉन एच को जोड़ने के लिए आवश्यक है। इसकी अनुपस्थिति में, माइटोकॉन्ड्रिया में पूरी प्रक्रिया रुक जाती है, क्योंकि इलेक्ट्रॉन परिवहन श्रृंखला कार्य करना बंद कर देती है। चरण III की सामान्य प्रतिक्रिया:
(2C3NbOz + 6Oz + 36ADP + 36F ---> 6C02 + 36ATP + +42H20)
एक ग्लूकोज अणु के टूटने के परिणामस्वरूप, 38 एटीपी अणु बनते हैं: चरण II में - 2 एटीपी और चरण III में - 36 एटीपी। परिणामी एटीपी अणु माइटोकॉन्ड्रिया से आगे जाते हैं और उन सभी सेलुलर प्रक्रियाओं में भाग लेते हैं जहां ऊर्जा की आवश्यकता होती है। विभाजित होने पर, एटीपी ऊर्जा छोड़ता है (एक फॉस्फेट बांड में 40 केजे होता है) और एडीपी और पी (फॉस्फेट) के रूप में माइटोकॉन्ड्रिया में लौटता है।
जीव विज्ञान में, एटीपी ऊर्जा का स्रोत और जीवन का आधार है। एटीपी - एडेनोसिन ट्राइफॉस्फेट - चयापचय प्रक्रियाओं में शामिल होता है और शरीर में जैव रासायनिक प्रतिक्रियाओं को नियंत्रित करता है।
यह क्या है?
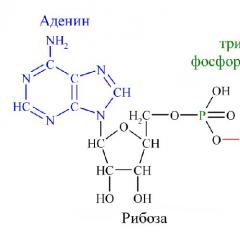
रसायन विज्ञान आपको यह समझने में मदद करेगा कि एटीपी क्या है। एटीपी अणु का रासायनिक सूत्र C10H16N5O13P3 है। यदि आप इसे इसके घटक भागों में विभाजित करते हैं तो पूरा नाम याद रखना आसान है। एडेनोसिन ट्राइफॉस्फेट या एडेनोसिन ट्राइफॉस्फोरिक एसिड एक न्यूक्लियोटाइड है जिसमें तीन भाग होते हैं:
- एडीनाइन - प्यूरीन नाइट्रोजनस आधार;
- राइबोज़ - पेंटोज़ से संबंधित एक मोनोसैकेराइड;
- तीन फॉस्फोरिक एसिड अवशेष।

चावल। 1. एटीपी अणु की संरचना।
एटीपी का अधिक विस्तृत विवरण तालिका में प्रस्तुत किया गया है।
एटीपी की खोज सबसे पहले 1929 में हार्वर्ड बायोकेमिस्ट सुब्बाराव, लोहमान और फिस्के ने की थी। 1941 में, जर्मन बायोकेमिस्ट फ्रिट्ज़ लिपमैन ने पाया कि एटीपी एक जीवित जीव के लिए ऊर्जा का स्रोत है।
ऊर्जा उत्पादन
फॉस्फेट समूह उच्च-ऊर्जा बंधों द्वारा आपस में जुड़े होते हैं जो आसानी से नष्ट हो जाते हैं। हाइड्रोलिसिस (पानी के साथ बातचीत) के दौरान, फॉस्फेट समूह के बंधन टूट जाते हैं, जिससे बड़ी मात्रा में ऊर्जा निकलती है, और एटीपी एडीपी (एडेनोसिन डिपोस्फोरिक एसिड) में परिवर्तित हो जाता है।
परंपरागत रूप से, रासायनिक प्रतिक्रिया इस तरह दिखती है:
शीर्ष 4 लेखजो इसके साथ ही पढ़ रहे हैं
एटीपी + एच2ओ → एडीपी + एच3पीओ4 + ऊर्जा

चावल। 2. एटीपी हाइड्रोलिसिस।
जारी ऊर्जा का एक भाग (लगभग 40 kJ/mol) उपचय (आत्मसातीकरण, प्लास्टिक चयापचय) में शामिल होता है, जबकि कुछ भाग शरीर के तापमान को बनाए रखने के लिए गर्मी के रूप में नष्ट हो जाता है। एडीपी के आगे हाइड्रोलिसिस के साथ, एक और फॉस्फेट समूह अलग हो जाता है, ऊर्जा जारी करता है और एएमपी (एडेनोसिन मोनोफॉस्फेट) बनाता है। एएमपी हाइड्रोलिसिस से नहीं गुजरता है।
एटीपी संश्लेषण
एटीपी साइटोप्लाज्म, न्यूक्लियस, क्लोरोप्लास्ट और माइटोकॉन्ड्रिया में स्थित होता है। पशु कोशिका में एटीपी संश्लेषण माइटोकॉन्ड्रिया में होता है, और पौधे कोशिका में - माइटोकॉन्ड्रिया और क्लोरोप्लास्ट में।
एटीपी ऊर्जा के व्यय के साथ एडीपी और फॉस्फेट से बनता है। इस प्रक्रिया को फॉस्फोराइलेशन कहा जाता है:
ADP + H3PO4 + ऊर्जा → ATP + H2O

चावल। 3. एडीपी से एटीपी का निर्माण।
पौधों की कोशिकाओं में, फॉस्फोराइलेशन प्रकाश संश्लेषण के दौरान होता है और इसे फोटोफॉस्फोराइलेशन कहा जाता है। जानवरों में, यह प्रक्रिया श्वसन के दौरान होती है और इसे ऑक्सीडेटिव फास्फारिलीकरण कहा जाता है।
पशु कोशिकाओं में, एटीपी संश्लेषण प्रोटीन, वसा और कार्बोहाइड्रेट के टूटने के दौरान अपचय (विघटन, ऊर्जा चयापचय) की प्रक्रिया में होता है।
कार्य
एटीपी की परिभाषा से यह स्पष्ट है कि यह अणु ऊर्जा प्रदान करने में सक्षम है। ऊर्जा के अलावा, एडेनोसिन ट्राइफॉस्फोरिक एसिड कार्य करता है अन्य कार्य:
- न्यूक्लिक एसिड के संश्लेषण के लिए एक सामग्री है;
- एंजाइमों का हिस्सा है और रासायनिक प्रक्रियाओं को नियंत्रित करता है, उनकी घटना को तेज या धीमा करता है;
- एक मध्यस्थ है - सिनैप्स (दो कोशिका झिल्लियों के बीच संपर्क के स्थान) तक एक संकेत भेजता है।
एटीपी सिंथेज़- एक एंजाइम (ईसी 3.6.3.14) जो एडीपी और फॉस्फेट आयन से एटीपी संश्लेषण की प्रतिक्रिया करता है, आमतौर पर प्रोटॉन की ट्रांसमेम्ब्रेन इलेक्ट्रोकेमिकल क्षमता की ऊर्जा के कारण (यानी, प्रोटॉन ग्रेडिएंट और विद्युत वोल्टेज का संयोजन), और कुछ जीवों में सोडियम आयनों की विद्युत रासायनिक क्षमता के कारण, इसे रासायनिक बंधों की ऊर्जा में परिवर्तित किया जाता है, जिसका उपयोग कोशिका द्वारा जैव रासायनिक प्रतिक्रियाओं में किया जा सकता है। ऐसे मामले में जब एंजाइम रिवर्स प्रक्रिया को अंजाम देता है - यह एटीपी हाइड्रोलिसिस के कारण एक ट्रांसमेम्ब्रेन प्रोटॉन ग्रेडिएंट बनाता है, इसे कहा जा सकता है ATPases।एंजाइम की क्रिया एंटीबायोटिक ओलिगोमाइसिन द्वारा बाधित होती है।
नामपद्धति
एटीपी सिंथेज़ एफ 1 एफ 0 में दो सबयूनिट होते हैं:
- एफ 0 कॉम्प्लेक्स का झिल्ली भाग
- माइटोकॉन्ड्रियल मैट्रिक्स या बैक्टीरियल साइटोप्लाज्म में कॉम्प्लेक्स का एफ 1 भाग।
एटीपी सिंथेज़ सबयूनिट का नामकरण काफी जटिल है और इसका एक लंबा इतिहास है। एफ 1-अंश को इसका नाम पद से मिलता है अंश 1 1"), और F0 (मूल रूप से "शून्य" के बजाय सबस्क्रिप्ट "O" के साथ लिखा गया था, जैसा कि अब अधिक सामान्य है) को उस अंश के रूप में नामित किया गया था जो ओलिगोमाइसिन को बांधता है।
अन्य एंजाइमों के उदाहरण के बाद, अधिकांश उपइकाइयों का नाम ग्रीक (α से ε) और लैटिन (ए से एच) अक्षरों के रूप में रखा गया है। शेष उपइकाइयों को जटिल नाम प्राप्त हुए:
- एफ 6 (से अंश 6)
- ओएससीपी (ओलिगोमाइसिन संवेदनशीलता कन्फरल प्रोटीन- "ऑलिगोमाइसिन के प्रति संवेदनशीलता का सहायक प्रोटीन")
- A6L (इस सबयूनिट को एन्कोड करने वाले माइटोकॉन्ड्रियल जीनोम में जीन के नाम पर)
- IF1 (निरोधात्मक कारक 1 -"निरोधात्मक कारक 1")
संचालन का डिज़ाइन और सिद्धांत
एटीपी सिंथेज़ कोशिका झिल्लियों में से एक पर स्थित होता है और इसमें एक F 0 डोमेन डूबा हुआ होता है और एक F 1 डोमेन मैट्रिक्स या साइटोप्लाज्म में फैला होता है, जो γ सबयूनिट द्वारा जुड़ा होता है। एंजाइम अस्पष्ट रूप से मशरूम के फलने वाले शरीर जैसा दिखता है (यही कारण है कि कोशिका जीव विज्ञान पर साहित्य में, विशेष रूप से पुराने लोगों में, एटीपी सिंथेज़ को कभी-कभी "मशरूम बॉडी" कहा जाता था)।
F 1 कॉम्प्लेक्स का व्यास लगभग 9-10 एनएम है और जब γ "पैर" नष्ट हो जाता है, तो यह झिल्ली से अलग हो सकता है, जिससे F 1 -ATPase बनता है। एफ 1 में तीन α और तीन β सबयूनिट होते हैं, जो जोड़े में जुड़ते हैं और तीन सक्रिय केंद्रों के साथ हेक्सामर्स बनाते हैं। जब γ सबयूनिट F 0 कॉम्प्लेक्स के साथ घूमता है तो संरचनाएं बदल जाती हैं। इस प्रक्रिया में प्रेरक शक्ति प्रोटॉन स्थानांतरण है, जो F 0 डोमेन द्वारा उत्प्रेरित होता है। इस प्रकार, प्रोटॉन सीधे ADP और की संघनन प्रतिक्रिया में शामिल नहीं होता है फॉस्फेट आयन. यह ध्यान दिया जाना चाहिए कि α 3 β 3 हेक्सामर्स स्वयं "स्टेटर" ए के सापेक्ष नहीं घूमता है, क्योंकि यह δ सबयूनिट द्वारा समाहित है, जो बदले में एफ के सबयूनिट बी ("स्टेम") से जुड़ा हुआ है। 1 कॉम्प्लेक्स (हालांकि एफ 1 को आमतौर पर स्थिर माना जाता है, वास्तव में, दोनों कॉम्प्लेक्स एक दूसरे के सापेक्ष विपरीत दिशाओं में घूमते हैं)।
एफ 1 कॉम्प्लेक्स के संचालन का सिद्धांत पहले एडीपी और फॉस्फेट को सक्रिय केंद्र में कमजोर रूप से बांधना है, जो फिर संरचना को बदलता है और उन्हें कसकर बांधता है, जिसके परिणामस्वरूप एटीपी संश्लेषण अनायास होता है। तीसरी संरचना में, एटीपी को सक्रिय साइट से निष्कासित कर दिया जाता है।
F0 कॉम्प्लेक्स (जिसे अक्सर "दुनिया की सबसे छोटी रोटरी इलेक्ट्रिक मोटर" कहा जाता है) का संचालन सिद्धांत एक प्रोटॉन के लिए "रोटर" (सी-रिंग) में बंधने से पहले "स्टेटर" (सबयूनिट ए) में एक चैनल से गुजरना है। झिल्ली के दूसरी ओर एक प्रोटॉन को छोड़ने के लिए, स्टेटर में एक अन्य चैनल के माध्यम से बाहर निकलना आवश्यक है, जो कुछ दूरी से स्थानांतरित होता है, अर्थात, रोटर से बाहर निकलने के लिए, स्टेटर के सापेक्ष घूमना आवश्यक है . इस प्रकार, रोटर को स्टेटर के सापेक्ष घुमाकर एक क्षैतिज संभावित अंतर बनाया जाता है।
शारीरिक भूमिका
एटीपीस की भूमिका में, एटीपी की ऊर्जा का उपयोग करके प्रोटॉन की एक ट्रांसमेम्ब्रेन इलेक्ट्रोकेमिकल क्षमता बनाने के लिए एनारोबिक बैक्टीरिया द्वारा एंजाइम का उपयोग किया जाता है। बदले में, इस ग्रेडिएंट का उपयोग फ्लैगेल्ला को घुमाने और आयनों को कोशिका में ले जाने के लिए किया जाता है।
एरोबिक बैक्टीरिया में, एंजाइम का उपयोग मुख्य रूप से एटीपी को संश्लेषित करने के लिए किया जाता है, इसके लिए विद्युत रासायनिक क्षमता श्वसन इलेक्ट्रॉन परिवहन श्रृंखला के कामकाज से उत्पन्न होती है। सामान्यतः इस प्रक्रिया को ऑक्सीडेटिव फास्फारिलीकरण कहा जाता है। यह यूकेरियोट्स के माइटोकॉन्ड्रिया में होता है, जिसकी आंतरिक झिल्ली पर एटीपी सिंथेज़ अणु स्थित होते हैं, और एफ 1 सबयूनिट मैट्रिक्स में स्थित होता है, जहां एडीपी और फॉस्फेट से एटीपी संश्लेषण की प्रक्रिया होती है।
एटीपी संश्लेषण भी प्रकाश संश्लेषण की प्रक्रिया में शामिल है; यह क्लोरोप्लास्ट के थायलाकोइड झिल्ली पर स्थानीयकृत होता है, जो एफ 1 सबयूनिट को स्ट्रोमा में उन्मुख करता है। इस मामले में एंजाइम के संचालन की संरचना और तंत्र लगभग माइटोकॉन्ड्रियल एटीपी सिंथेज़ के समान है, हालांकि, प्रोटॉन इलेक्ट्रोकेमिकल क्षमता मौलिक रूप से अलग इलेक्ट्रॉन परिवहन श्रृंखला में बनती है।