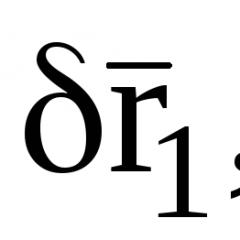Лабораторний практикум з хімії та коледжу. Практикум з хімії методична розробка з хімії (9 клас) на тему
Папка містить матеріали, які допоможуть організувати практичну частину з хімії для дітей з обмеженими можливостями здоров'я та за дистанційної форми навчання
Завантажити:
Попередній перегляд:
Щоб користуватися попереднім переглядом, створіть собі обліковий запис Google і увійдіть до нього: https://accounts.google.com
Попередній перегляд:
МОНІТОРИНГ ДОСЯГНЕННЯ ПЛАНУЮЧИХ РЕЗУЛЬТАТІВ У КУРСІ ХІМІЇ (З ДОСВІДУ РОБОТИ)
Душак Ольга Михайлівна
Крайова бюджетна загальноосвітня установа «Школа дистанційної освіти», м. КиївЗалізногірськ,
Ключові слова: новий ФГОС, плановані результати, хімія, поточний контроль, мікроуміння
Анотація: У статті описано досвід використання таких форм контролю як Лист зворотного зв'язку та Лист досягнень запланованих результатів у курсі Хімія 8-9 клас.
Діяльність вчителя у межах нового освітнього стандарту орієнтована результат. Запланований результат освіти, прописаний Федеральному державному освітньому стандарті, є диференційованим. Заплановані результати освоєння навчальних програм наводяться у двох блоках: «Випускник навчиться» (базовий рівень) та «Випускник отримає можливість навчитися» (підвищений рівень). На сайті ФІПД вчитель та учень може ознайомитися з вимірювальними матеріалами для підсумкової атестації учнів. Для якісного проходження підсумкової атестації учень повинен опанувати систему понять, предметних знань і умінь. Перед учителем постає завдання щодо формування цих знань та умінь, створення системи оцінювання досягнення планованих результатів у ході поточного контролю. Вивчивши матеріали нового ФГОС, методичну літературу, досвід колег, я розпочала створення власної системи відстеження результативності досягнення планованих результатів щодо тем курсу Хімії 8-9 класів. За основу класифікації я взяла систему, розглянуту О.О.Каверіною с.н.с. Центру природничо освіти Інституту стратегії розвитку освіти РАВ, к.п.н.
Для оцінки досягнення запланованих результатів необхідно розробити критерії. Критерії мають бути розроблені коректно, доступно та відображати поетапне засвоєння знань та умінь для створення комфортних умов набуття дитиною пізнавального досвіду, її просування із зони актуального розвитку до зони найближчого розвитку та надалі. Протягом останнього навчального року мною було розроблено та апробовано алгоритми виконання завдань, листи зворотного зв'язку, листи досягнень за деякими розділами курсу Хімії у 8-9 класах.
У ході навчального процесу, на початку вивчення кожної теми, учням пропонується список понять для підсумкового заліку та критерії оцінювання їх навчальних результатів у вигляді умінь та мікроумінь, відображені у Листах зворотного зв'язку та завдання до них. У результаті вивчення теми результати відзначаються у Листі досягнень. Завдання можна використовувати і для вивчення нової теми, і для закріплення, узагальнення навчального матеріалу. Наприклад, у Розділі Розмаїття хімічних реакцій відпрацьовуються вміння: складати рівняння електролітичної дисоціації кислот, лугів, солей; складати повні та скорочені іонні рівняння реакцій обміну. Лист зворотного зв'язку, який отримує учень, містить мікроуміння для поетапного виконання завдання, яке також додається. Для оцінки власних результатів я пропоную учням просту шкалу: Вмію + Не вмію-.
Завдання №1 Скласти формули солей, використовуючи значення валентності для металу та кислотного залишку; назвати речовини, написати рівняння дисоціації (текст завдання наведено як фрагмента).
Кислоти | Метали | Рівняння дисоціації однієї солі |
||||
Fe (II) | Fe (III) |
|||||
Назва | ||||||
HNO 3 | ||||||
Назва | ||||||
Критерії оцінювання: Вмію + Не вмію -
Завдання №2 Скласти формули запропонованих речовин, визначити клас, написати рівняння дисоціації цих речовин: хлорид калію, нітрат срібла, карбонат натрію, сульфат магнію, нітрат свинцю, сульфід калію, фосфат калію (текст завдання наведено у вигляді фрагмента).
Аркуш зворотного зв'язку_________________________________________Ф.І.
Тема: Іонні рівняння БАЗОВИЙ РІВЕНЬ!
Я вмію: ДАТИ: | Залік |
|||
Складати формули складних речовин за валентністю | ||||
Визначати клас | ||||
Називати речовину | ||||
Писати рівняння дисоціації речовини |
Критерії оцінювання:Вмію + Не вмію -
Завдання №3 Написати рівняння реакцій обміну між запропонованими парами речовин. Зрівняти, скласти повне та скорочене іонні рівняння (текст завдання наведено у вигляді фрагмента).
Аркуш зворотного зв'язку________________________________________Ф.І.
Тема: Іонні рівняння БАЗОВИЙ РІВЕНЬ!
Я вмію: ДАТИ: | Залік |
|||
Писати продукти реакції обміну | ||||
Розставляти коефіцієнти | ||||
Визначати речовини, які не піддаються дисоціації | ||||
Записувати повне іонне рівняння | ||||
Записувати скорочене іонне рівняння |
Критерії оцінювання:Вмію + Не вмію -
Після успішного виконання завдань базового рівня учень отримує можливість виконати завдання підвищеного рівня, що свідчить про сформованість умінь застосовувати отримані знання для вирішення навчальних та навчально-практичних завдань у зміненій, нестандартній ситуації, а також умінні систематизувати та узагальнювати отримані знання.
Наприклад, під час виконання завдання №3 напідвищеному рівні, учень може сформулювати висновок у тому, у разі реакції іонного обміну протікають остаточно. Використовуючи Таблицю розчинності кислот, основ і солей скласти приклади молекулярних рівнянь даних скорочених іонних: Ba 2+ + SO 4 2- = BaSO 4 ; CO 3 2- + 2H + = H 2 O + CO 2 і т.п.
Така організація навчального процесу показала низку переваг: можливість індивідуальної траєкторії при засвоєнні теми, зрозумілі дитині та її батькам критерії оцінювання результатів роботи. Надалі планується продовжити роботу над розробкою завдань та за іншими розділами курсу.
Бібліографічний список:
1. Каверіна А.А. Хімія. Заплановані результати. Система завдань. 8-9 класи: посібник для вчителів загальноосвітніх закладів/А.А.Каверіна, Р.Г.Іванова, Д.Ю, Добротін; за ред. Г.С.Ковальової, О.Б.Логінової. - М.: Просвітництво, 2013. - 128 с. – (Працюємо за новими стандартами)
Попередній перегляд:
8 клас Практична робота по темі:Аналіз грунту та води
Досвід 1
Механічний аналіз ґрунту
У пробірку (або пляшечку) помістіть ґрунт (стовпчик ґрунту має бути 2-3 см). Прилийте дистильовану воду(кип'ячену), обсяг якої повинен бути в 3 рази більший за обсяг грунту.
Закрийте пробкою пробірку і ретельно струшуйте 1-2 хв, а потім озброїться лупою і спостерігайте за осадженням частинок грунту і структурою опадів. Опишіть та поясніть свої спостереження.
Досвід 2
Отримання ґрунтового розчину та досліди з ним
Приготуйте паперовийфільтр (або з вати, бинта), вставте його у вирву, закріплену в кільці штатива. Підставте під вирву чисту суху пробірку і профільтруйте отриману в першому досвіді суміш ґрунту та води. Перед фільтруванням суміш не слід струшувати. Грунт залишиться на фільтрі, а зібраний у пробірці фільтрат є ґрунтовою витяжкою (ґрунтовий розчин).
Декілька крапель цього розчину помістіть на скляну пластинку і за допомогою пінцету потримайте її над пальником до випаровування води(просто залишити на батареї).Що спостерігаєте? Поясніть.
Візьміть два лакмусові папірці (червоний та синій)(якщо є!), нанесіть на них скляною паличкою ґрунтовий розчин. Зробіть висновок щодо результатів своїх спостережень:
1. Після випаровування води на склі ………..
2. Універсальний лакмусовий папірець не змінить свій колір якщо розчин нейтральний, стане червоним, якщо він кислий, і синім якщо він лужним.
Досвід 3
Визначення прозорості води
Для досвіду потрібен прозорий скляний плоскодонний циліндр(висока склянка) діаметром 2-2,5 см, висотою 30-35 см. Можна використовувати мірний циліндр на 250 мл без пластмасової підставки. Вкажіть розміри своєї склянки
Ми рекомендуємо провести досвід спочатку з дистильованою водою, а потім із водою з водойми та порівняти результати. Встановіть циліндр на друкований текст і вливайте воду, що досліджується, стежачи за тим, щоб можна було читати через воду текст. Позначте, на якій висоті ви не бачитимете шрифт. Виміряйте висоти стовпів води лінійкою. Зробіть висновки:
Виміряна висота називається рівнем видимості.
Якщо рівень видимості малий, значить водоймище сильно забруднене.
Досвід 4
Визначення інтенсивності запаху води
Конічну колбу(баночку) наповніть на 2/3 об'єму досліджуваної водою, щільно закрийте пробкою (бажано скляною) і сильно струсіть. Потім відкрийте колбу та відзначте характер та інтенсивність запаху. Дайте оцінку інтенсивності запаху води у балах, користуючись таблицею 8.
Скористайтеся таблицею 8 (стор. 183).
ЗРОБІТЬ ЗАГАЛЬНИЙ ВИСНОВОК
Попередній перегляд:
Розділ V Експериментальна хімія
- Виявляти при виконанні хімічного досвіду ознаки, що свідчать про перебіг хімічної реакції
- Проводити досліди з розпізнавання водних розчинів кислот та лугів за допомогою індикаторів.
Поняття на тему:
Хімічне явище (реакція), експеримент, кислота, луг, ознаки хімічної реакції, розчин, індикатори
Ознаки хімічної реакції:
Зміна кольору, поява запаху, випадання або розчинення осаду, виділення газу, виділення чи поглинання тепла та світла
Завдання №1
Лист зворотного зв'язку__________________________________________Ф.І.
Експериментальна хімія. Ознаки хімічних реакцій
Я вмію: ДАТИ: | Залік |
|||
Дотримуватися правил роботи з речовинами | ||||
Фіксувати зміни, що відбуваються з речовинами під час досвіду | ||||
Виявляти ознаки хімічної реакції | ||||
Фіксувати спостереження | ||||
Писати рівняння реакції у молекулярному вигляді | ||||
Формулювати висновок |
Критерії оцінювання: Вмію + Не вмію -
Назва досвіду | Тривалість ролика, електронна адреса | Ознаки реакції | Рівняння реакції |
|
Взаємодія кислот із металами | 37 сек | |||
Взаємодія оксиду міді та сірчаної кислоти | 41 сек |
№ п/п
Розділи, теми
Кількість годин
Робоча програма за класами
10 кл.
11 кл.
Вступ
1. Розчини та способи їх приготування
2. Обчислення за хімічними рівняннями
3. Визначення складу сумішей
4. Визначення формули речовини
5. Закономірності перебігу хімічних реакцій
6. Комбіновані завдання
7. Якісні реакції
Введення у хімічний аналіз.
Хімічні процеси.
Хімія елементів.
Корозія металів.
Харчова хімія.
Фармакологія
Підсумкова конференція: «Значення експерименту з природничих науках».
Разом:
Пояснювальна записка
Даний елективний курс призначений для учнів 10 - 11 класів вибирають природничо напрям, розрахований на 68 годин.
Актуальність курсу полягає в тому, що його вивчення дозволить навчитися вирішувати основні типи розрахункових завдань, які передбачені курсом хімії середньої школи та програмою вступних іспитів до ВНЗ, тобто успішно підготуватися до ЄДІ з хімії. Крім того, компенсується нестача практичних занять. Це робить заняття захоплюючими та прищеплює навички роботи з хімічними реактивами та обладнанням, розвиває спостережливість та вміння логічно мислити. У цьому курсі зроблено спробу максимально використовувати наочність хімічного експерименту, дати можливість учням як побачити як взаємодіють речовини, а й виміряти, у яких співвідношеннях вони входять у реакції і виходять у результаті реакції.
Ціль курсу:розширення уявлень учнів про хімічний експеримент.
Завдання курсу:
· Повторення матеріалу, розглянутого на уроках хімії;
· Розширення уявлень учнів про властивості речовин;
· Удосконалення практичних навичок та навичок вирішення розрахункових завдань на різні типи;
· Подолання формального уявлення деяких школярів про хімічні процеси.
На заняттях курсу учні вдосконалюють уміння у вирішенні розрахункових завдань, виконують якісні завдання на ідентифікацію речовин, що знаходяться у різних склянках без етикеток, експериментально здійснюють ланцюжки перетворень.
У ході виконання експерименту на заняттях формуються п'ять типів умінь та навичок.
1. Організаційні вміння та навички:
складання плану експерименту з інструкції;
визначення переліку реактивів та обладнання за інструкцією;
підготовка форми звіту щодо інструкції;
виконання експерименту в заданий час, використання знайомих засобів, методів та прийомів у роботі;
здійснення самоконтролю за інструкцією;
знання вимог до письмового оформлення результатів експерименту
2. Технічні вміння та навички:
правильне поводження з відомими реактивами та обладнанням;
збирання приладів та установок з готових деталей за інструкцією;
виконання хімічних операцій із інструкції;
дотримання правил безпеки праці.
3. Вимірювальні вміння та навички:
робота з вимірювальними приладами відповідно до інструкції;
знання та використання методів вимірювань;
обробка результатів вимірів.
4. Інтелектуальні вміння та навички:
уточнення мети та визначення завдань експерименту;
висування гіпотези експерименту;
відбір та використання теоретичних знань;
спостереження та встановлення характерних ознак явищ та процесів за інструкцією;
порівняння, аналіз, встановлення причинно-наслідкових зв'язків,
узагальнення отриманих результатів та - формулювання висновків.
5. Конструкторські вміння та навички:
виправлення найпростіших неполадок в устаткуванні, приладах та установках під контролем вчителя;
користування готовим обладнанням, приладами та установками;
виготовлення найпростішого обладнання, приладів та установок під керівництвом вчителя;
зображення обладнання, приладів та установок у вигляді малюнка.
Контроль знань здійснюється при вирішенні розрахункових та експериментальних завдань.
Підсумком роботи за елективним курсом стане виконання залікової роботи, що включає складання, рішення та експериментальне виконання розрахункового завдання або якісного завдання: визначення складу речовини або здійснення ланцюжка перетворень.
Введення (1 год)
Планування, підготовка та проведення хімічного експерименту. Техніка безпеки під час проведення лабораторних та практичних робіт. Правила надання першої медичної допомоги при опіках та отруєннях хімічними реактивами.
Тема 1. Розчини та способи їх приготування (4 години)
Значення розчинів у хімічному експерименті. Концепція істинного розчину. Правила приготування розчинів. Технохімічні ваги та правила зважування твердих речовин.
Масова частка розчиненої речовини у розчині. Розрахунок та приготування розчину з певною масовою часткою розчиненої речовини.
Визначення об'ємів розчинів за допомогою мірного посуду та густини розчинів неорганічних речовин за допомогою ареометра. Таблиці густин розчинів кислот і лугів. Розрахунки маси розчиненої речовини за відомою щільністю, обсягом та масовою часткою розчиненої речовини.
Зміна концентрації розчиненої речовини у розчині. Змішування двох розчинів однієї речовини з метою одержання розчину нової концентрації. Розрахунки концентрації розчину, одержаного при змішуванні, правило «хреста».
Демонстрації. Хімічний посуд для приготування розчинів (склянки, конічні та плоскодонні колби, мірні циліндри, мірні колби, скляні палички, скляні лійки тощо). Приготування розчину хлориду натрію та розчину сірчаної кислоти. Технохімічні ваги, ваги. Визначення об'єму розчинів кислот та лугів за допомогою мірного циліндра. Ареометр. Визначення густини розчинів за допомогою ареометра. Збільшення концентрації розчину гідроксиду натрію за допомогою часткового випаровування води і додавання додаткової кількості лугу в розчин, перевірка зміни концентрації за допомогою ареометра. Зменшення концентрації натрію гідроксиду в розчині за рахунок його розведення, перевірка зміни концентрації за допомогою ареометра.
Практичні роботи Зважування на технохімічних терезах хлориду натрію. Приготування розчину хлориду натрію із заданою масовою часткою солі в розчині. Визначення об'єму розчину хлориду натрію за допомогою мірного циліндра та визначення його густини за допомогою ареометра. Визначення концентрації розчинів кислот і лугів за значеннями їх густин у таблиці «Масова частка розчиненої речовини (в %) та густина розчинів кислот і основ при 20 °С». Змішування розчинів хлориду натрію різної концентрації та розрахунок масової частки солі, та визначення густини отриманого розчину.
Тема 2. Обчислення за хімічними рівняннями (10 годин)
Практичне визначення маси однієї з реагуючих речовин за допомогою зважування або за обсягом, щільністю та масовою часткою розчиненої речовини в розчині. Проведення хімічної реакції та розрахунок по ураненню цієї реакції. Зважування продукту реакції та пояснення відмінності отриманого практичного результату від розрахункового.
Практичні роботи Визначення маси оксиду магнію, одержаного при спалюванні відомої маси магнію. Визначення маси натрію хлориду, отриманого при взаємодії розчину, що містить відому масу гідроксиду натрію, з надлишком соляної кислоти.
Практичне визначення маси однієї з реагуючих речовин за допомогою зважування, проведення хімічної реакції та розрахунок хімічного рівняння цієї реакції, визначення маси або обсягу продукту реакції та його виходу у відсотках від теоретично можливого.
Практичні роботи Розчинення цинку в соляній кислоті та визначення об'єму водню. Прожарювання перманганату калію та визначення об'єму кисню.
Проведення реакцій речовин, що містять домішки, спостереження результатів експерименту. Розрахунки з визначенням масової частки домішок у речовині за наслідками хімічної реакції.
Демонстраційний експеримент. Розчинення у воді натрію, кальцію та спостереження результатів експерименту з метою виявлення домішок у цих металах.
Практична робота. Розчинення в розчині азотної кислоти порошку крейди, забрудненої річковим піском.
Визначення мас реагуючих речовин, проведення хімічної реакції між ними, дослідження продуктів реакції та практичне визначення речовини, що перебуває у надлишку. Розв'язання завдань визначення маси однієї з продуктів реакції з відомих мас реагуючих речовин, одне з яких дано надлишку.
Демонстраційний експеримент. Горіння сірки і фосфору, визначення речовини, що перебуває у надлишку цих реакціях.
Практичні роботи Проведення реакції між розчинами азотної кислоти і гідроксиду натрію, що містять відомі маси речовин, що реагують, визначення надлишку реагенту за допомогою індикатора.
Тема 3. Визначення складу сумішей (2 години)
Проведення реакції суміші двох речовин з реактивом, що взаємодіє тільки з одним компонентом суміші. Проведення реакції суміші двох речовин з реактивом, що взаємодіє з усіма компонентами суміші. Обговорення результатів експерименту. Розв'язання завдань визначення складу сумішей.
Демонстраційний експеримент. Взаємодія суміші цинкового пилу та мідної тирси з соляною кислотою. Взаємодія суміші порошку магнію та цинкового пилу із соляною кислотою.
Тема 4. Визначення формули речовини (6 годин)
Поняття про якісний та кількісний склад речовини. Обчислення молекулярної маси речовини з урахуванням його щільності водню тощо. та масової частки елемента. Визначення формули речовини, виходячи з кількісних даних продуктів реакції. Визначення формули органічних речовин з урахуванням загальної формули гомологічного ряду.
Тема 5. Закономірності протікання хімічних реакцій (5 годин)
Поняття про теплові процеси при хімічних реакціях. Екзо- та ендотермічні реакції. Обчислення за термохімічними рівняннями.
Демонстрації. Реакція розведення концентрованої сірчаної кислоти та приготування хлориду амонію.
Поняття швидкості реакції. Чинники, що впливають швидкість реакції. Визначення швидкості реакції.
Демонстрації. Вплив умов перебігу реакцію її швидкість.
Концепція хімічної рівноваги. Способи усунення хімічної рівноваги. Застосування даних знань у хімічному виробництві.
Тема 6. Комбіновані завдання (3 години)
Вирішення комбінованих завдань на різні типи блоку С ЄДІ з хімії.
Тема 7. Якісні реакції (3 години)
Поняття якісної реакції. Визначення речовин за допомогою таблиці розчинності кислот, основ та солей, характеристика видимих змін процесів. Визначення неорганічних речовин, що у різних склянках без етикеток, без використання додаткових реактивів. Здійснення перетворень неорганічних та органічних речовин.
Демонстраційний експеримент. Ідентифікація розчинів сульфату заліза (II), сульфату міді (II), хлориду алюмінію, нітрату срібла за допомогою розчину гідроксиду натрію. Ідентифікація розчинів хлориду натрію, іодиду калію, фосфату натрію, нітрату кальцію за допомогою розчину нітрату срібла та азотної кислоти.
Здійснення ланцюжка перетворень.
Практичні роботи Визначення в пронумерованих склянках без етикеток розчинів нітрату срібла, гідроксиду натрію, хлориду магнію, цинку нітрату без використання додаткових реактивів.
Тема 8. Введення у хімічний аналіз (6 годин)
Вступ. Хімія, людина та сучасне суспільство. Введення у хімічний аналіз. Основи якісного аналізу. Основи аналітичної хімії. Розв'язання типових розрахункових задач.
Практичні роботи Проведення аналізу з виявлення слідів крові та слини у виданих пробах. Аналіз чіпсів та прохолодних напоїв.
Тема 9. Хімічні процеси (6 годин)
Характеристики хімічних процесів. Хімічний процес, ознаки. Кристали у природі. Кристалізація речовин та її залежність від різних факторів. Хімічні процеси у людини. Біохімія та фізіологія.
Практичні роботи Кристалізація речовини. Вирощування кристалів у лабораторії. Розкладання пероксиду водню ферментами крові.
Тема 10. Хімія елементів (5 годин)
Сутність хімічної реакції. Розв'язання задач за участю речовин різних класів та визначення типу хімічної реакції. Хімічні реакції, що йдуть без зміни ступеня окиснення хімічних елементів. Реакції, що йдуть зі зміною ступеня окиснення хімічних елементів. Реакція іонного обміну.
Практична робота. Осадження солей.
Тема 11. Корозія металів (3 години)
Концепція корозії. Ознаки поверхні, що корродує. Хімічна та електрохімічна корозія. Захист від корозії.
Практична робота. Прийоми захисту металевої поверхні від корозії.
Тема 12. Харчова хімія (7 годин)
Хімія та харчування. Значення білків, жирів та вуглеводів для повноцінного харчування. Чинники, що впливають на засвоєння найважливіших компонентів їжі. Хімічні характеристики процесів, що відбуваються у травному тракті. «Жива» та «мертва» їжа. Хімізм вегетаріанства та м'ясоїдіння. Ароматизатори, консерванти, барвники та підсилювачі смаку.
Практичні роботи Визначення штучних барвників у їжі. Виділення білків із біологічних об'єктів.
Тема 13. Фармакологія (4 години)
Концепція фармакології. Рецепт та призначення. Гомеопатія, її хімічні засади. Протипоказання та побічність ефекту, хімізм.
Практичні роботи Дія антибіотиків та нітратів на ґрунтову мікрофлору.
Тема 14. Підсумкова конференція: "Значення експерименту в природничих науках" (3 години)
Від натрохтимії до хіміотерапії (лікарська хімія). Хімізм біології харчування. Вирішення типових хімічних завдань для виходу на ЄДІ.
Вимоги до результатів навчання
На заняттях елективного курсу «Експериментальні завдання з хімії» учні повинні суворо виконувати вимоги техніки безпеки під час проведення лабораторних та практичних робіт, знати правила надання першої медичної допомоги при опіках та отруєннях хімічними реактивами.
Після вивчення пропонованого курсу учні повинні:
вміти проводити вимірювання (маси твердої речовини за допомогою технохімічних ваг, об'єму розчину за допомогою мірного посуду, густини розчину за допомогою ареометра); готувати розчини із заданою масовою часткою розчиненої речовини; визначати відсоткову концентрацію розчинів кислот і лугів за табличними значеннями їх густин; планувати, готувати та проводити найпростіші хімічні експерименти, пов'язані з розчиненням, фільтруванням, випарюванням речовин, промиванням та сушінням опадів; отриманням та взаємодією речовин, що належать до основних класів неорганічних сполук; визначення неорганічних речовин в індивідуальних розчинах; здійсненням ланцюжка перетворень неорганічних сполук;
вирішувати комбіновані завдання, що включають елементи типових розрахункових задач:
визначення маси та масової частки розчиненої речовини в розчині, отриманому різними способами (розчиненням речовини у воді, змішуванням розчинів різної концентрації, розведенням та концентруванням розчину);
визначення маси продукту реакції або обсягу газу за відомою масою однієї з реагуючих речовин; визначення виходу продукту реакції у відсотках від теоретично можливого;
визначення маси продукту реакції або обсягу газу за відомою масою однієї з реагуючих речовин, що містить певну частку домішок;
визначення маси одного з продуктів реакції за відомими масами реагуючих речовин, одна з яких дано в надлишку.
Список літератури:
1. Габрієлян О.С. Загальна хімія: завдання та вправи. М: Просвітництво, 2006.
2. Гудкова А.С. 500 завдань з хімії. М: Просвітництво, 2001.
3. Завдання Всеросійських олімпіад з хімії. М.: Іспит, 2005.
4. Лабій Ю.М. Розв'язання задач з хімії за допомогою рівнянь та нерівностей. М: Просвітництво, 2007
5. Магдесієва Н.М., Кузьменко Н.Є. Вчися вирішувати завдання з хімії. М: Просвітництво, 2006.
6. Новошинський І.І. Типи хімічних завдань та способи їх вирішення. М: Онікс, 2006.
7. Окаєв Є.Б. Олімпіади з біології. Мн.: ТетраСистемс, 2005.
8. КІМИ ЄДІ з хімії за різні роки
Номер
уроку
(розділи, теми)
Кількість
годин
Дата проведення
Обладнання уроку
Домашнє завдання
1. Введення.
ПСХЕ Д.І.Менделєєва, портрети вчених
Вступ.
2. Розчини та способи їх приготування
Спиртування, штатив для пробірок, пробірки, дріт для полум'яного тіста, фільтрувальний папір, чашка для випарювання, універсальний індикаторний папір, розчини азотної кислоти, хлориду барію, гідроксиду натрію, вапняна вода, нітрат срібла
Масова частка розчиненої речовини.
Молярна концентрація та молярна концентрація еквівалента.
Розчинність речовин.
Практична робота № 1: "Приготування розчину певної концентрації змішуванням розчинів різних концентрацій".
3. Обчислення за хімічними рівняннями
Спиртування, штатив, щипці, шпатель, склянка, пробірки, крапельниця, мірний циліндр, фільтрувальна лійка, фільтрувальний папір, розчини азотної кислоти, нітрату срібла, соляної кислоти, ПСХЕ Д.І.Менделєєва, таблиця розчинності, калькулятор
Визначення маси продукту реакції за відомою масою однієї з реагуючих речовин.
Обчислення об'ємних відносин газів.
Завдання, пов'язані із визначенням маси розчину.
Обчислення маси, обсягу, кількості речовини продукту реакції, якщо одне з реагуючих речовин дано надлишку.
Проведення реакції між речовинами, що містять відомі маси речовин, що реагують, визначення надлишку за допомогою індикатора.
Визначення виходу продукту реакції у відсотках теоретично можливого.
Розрахунок домішок у реагуючих речовинах.
4. Визначення складу сумішей
Спиртування, штатив, склянка, мірний циліндр, чашка для випарювання, фільтрувальний папір, магній, сірчана кислота, оксид міді (II), магнію карбонат, гідроксид натрію, соляна кислота
Визначення складу суміші, всі компоненти якої взаємодіють із зазначеними реагентами.
Визначення складу суміші, компоненти якої вибірково взаємодіють із зазначеними реагентами.
5. Визначення формули речовини
Виведення формули речовини на основі масової частки елементів.
Виведення молекулярної формули речовини на основі його щільності воднем або повітрям і масовою частиною елемента.
Виведення молекулярної формули речовини щодо відносної щільності її пари та маси, обсягу або кількості речовини продуктів згоряння.
Виведення формули речовини на основі загальної формули гомологічного ряду органічних сполук.
6. Закономірності перебігу хімічних реакцій
ПСХЕ Д.І.Менделєєва, таблиця розчинності, картки із завданнями
Розрахунки за термохімічними рівняннями.
Швидкість хімічних реакцій.
Хімічна рівновага.
7. Комбіновані завдання
ПСХЕ Д.І.Менделєєва, таблиця розчинності, картки із завданнями
Комбіновані завдання.
8. Якісні реакції
Широка пробірка з газовідвідною трубкою, штатив, секундомір, газовий шприц, мірний циліндр, цинкові гранули та порошок, розбавлена соляна кислота, розчин пероксиду водню, оксид марганцю (IV), оксид міді (II), оксид цинку, хлорид натрію, скибочки шматочки печінки.
Способи визначення неорганічних та органічних речовин.
Експериментальне визначення неорганічних речовин.
Експериментальне визначення органічних речовин.
34 година
ДЕРЖАВНА ОСВІТАЛЬНА УСТАНОВА ВИЩОЇ ПРОФЕСІЙНОЇ ОСВІТИ
«Сибірський державний медичний університет
Федерального агентства з охорони здоров'я та соціального розвитку»
ПРАКТИКУМ З ЗАГАЛЬНОЇ ХІМІЇ
ДЛЯ СТУДЕНТІВ ЛІКАРСЬКИХ ФАКУЛЬТЕТІВ
Навчальний посібник
За редакцією професора, д.х.н. М.С. Юсубова
«Рекомендується Навчально-методичним об'єднанням з медичної та фармацевтичної освіти ВНЗ Росії як навчальний посібник для студентів, які навчаються за спеціальністю 060101 (040100) – “Лікувальна справа”, 060103 (040200) – “Педіатри
Томськ Сибірський державний медичний університет
УДК 54 (075) ББК Гя 7 П 691
Практикум із загальної хімії для студентів лікарських факультетів: Навчальний посібник / авториПередеріна І. А., Дьякова А. С., Тверякова Є. Н.,
Бистрова М. О.; за редакцією професора, д.х.н. Юсубова М. С. - 4-те вид., Стереотип. - Томськ: СібДМУ, 2010 - 92 с.
Навчальний посібник (практикум) написано відповідно до нової навчальної програми загальної хімії (2000 р.) для студентів лікувальних, педіатричних та медико-профілактичних факультетів медичних вузів. Воно містить матеріал про класичні та сучасні методи отримання хімічної інформації. У посібнику представлений великий банк практичних та ситуаційних завдань, що допоможе студентам самостійно готуватися до експериментальної роботи.
Рецензенти:
завідувач кафедри загальної та біоорганічної хімії Новосибірського державного університету, д. м. н., професор – С. Ф. Некрасова;
завідувач кафедри загальної та біоорганічної хімії Кемеровської державної медичної Академії, к. х. н., доцент - Н. Г. Демідова.
«Рекомендується Навчально-методичним об'єднанням з медичної та фармацевтичної освіти вузів Росії як навчальний посібник для студентів, які навчаються за спеціальністю 060101 (040100) - "Лікувальна справа", 060103 (040200) - "0800002-0003-0003-0003-00000000000000000000000000000" р.)
1. ВСТУП У ПРАКТИКУМ З ЗАГАЛЬНОЇ ХІМІЇ
1. Техніка безпеки та правила роботи у хімічній лабораторії медичного університету.
2. Перша медична допомога у хімічній лабораторії.
3. Правила роботи зі скляним посудом.
4. правила оформлення лабораторного звіту.
5. Методи одержання хімічної інформації.
1.1. Інструкція з техніки безпеки для
запобігання нещасним випадкам
1. Кожен студент повинен знати, де знаходяться водопровідні крани,
засоби пожежогасіння та медична аптечка.
2. Роботи з токсичними сполуками проводять у витяжних шафах.
3. Потрібно підтримувати порядок на робочому місці. Не допускається велике скупчення працюючих у лабораторії.
4. Особливої обережності слід дотримуватись при роботі з концентрованими кислотами та лугами.
Забороняється відбирати піпеткою їдкі та токсичні рідини ротом.
5. При розведенні концентрованих кислот необхідно вливати кислоту у воду, а чи не навпаки.
6. Слід бути обережними при поводженні зі скляними приладами.
7. Лабораторну роботу слід розпочинати після детального вивчення методики роботи.
8. Під час заняття черговий має стежити за дотриманням студентами правил роботи у хімічній лабораторії.
1.2. Медична допомога
Студенти зобов'язані знати заходи надання першої допомоги у разі нещасних
1. При слабких термічних опіках охолодити уражену ділянку під струменем водопровідної води. При великих термічних опіках закрити стерильною марлею. Не розкривати бульбашки.
2. При хімічних опіках кислотами слід промити уражену ділянку великою кількістю проточної води, а потім 1-2% розчином NaHCO3
(питної соди).
3. При попаданні крапель кислоти в очі промити їх проточною водою протягом 15-20 хв, а потім 1% розчином NaHCO3.
4. При опіках лугами промити уражену ділянку великою кількістю проточною водою, а потім 1% розчином оцтової чи лимонної кислот.
5. При ураженні очей лугами необхідно протягом 15 – 20 хв промивати їх проточною водою, а потім обполоснути.%-м розчином борної кислоти.
6. При опіках рота, шлунка випити велику кількість води. При попаданні кислот пити завись крейди, лугів – розведений розчин харчового оцту чи лимонної кислоти.
7. Невеликі травми та порізи для зупинки кровотечі обробити розчином пероксиду водню та скляною паличкою нанести тонкий шар клею БФ-6 або колодію з антибіотиками. Через 1-2 хвилини утворюється міцна еластична плівка, що оберігає рану від проникнення інфекцій.
8. У разі отруєння газами потерпілого вивести на свіже повітря.
Штучне дихання роблять лише у разі потреби.
9. При отруєнні отрутами слід випити насичений розчин кухонної солі, викликати сильне блювання.
При отруєнні оцтовою кислотоюдати всередину палену магнезію,
молоко. Викликати лікаря. При стиснутому диханні застосовувати штучне дихання. Викликати блювання протипоказано.
При отруєнні хловодневою кислотоюзастосовувати ті ж засоби,
що і при отруєнні оцтової.
При отруєнні щавлевою кислотоюнегайно дати чисту крейду і карбонат магнію, збовтані з водою.
При отруєнні з'єднаннями ртутінегайно викликати блювання. До прибуття лікаря потерпілому дати молоко, яєчний білок. Добре також дати активоване вугілля.
При отруєннях розчинами з'єднань свинцюнегайно дати всередину 10%-й розчин сульфатів натрію або магнію, а також молоко,
яєчний білок, багато активованого вугілля.
При отруєнні сполуками хромунегайно викликати блювоту та промити шлунок, потім дати випити білок сирого яйця.
При попаданні йоду або його розчинів викликати блювання, а потім дати
1 %-й розчин тіосульфату натрію (спочатку 100 мл, а потім через
10 хвилин по столовій ложці).
З'єднання барію. Перша допомога – промити шлунок 1%-м
розчином сульфатів натрію або магнію для зв'язування іонів барію у вигляді малорозчинного сульфату барію. Після цього давати всередину
10% розчин сульфату натрію або магнію по одній столовій ложці через 5 хв. Через 30 хв викликати блювання для видалення сульфату барію.
Гексаціаноферати калію. Дати блювоту та негайно викликати лікаря.
Напувати концентрованими розчинами глюкози або цукру. За потреби – робити штучне дихання.
1.3. Правила роботи з посудом, що застосовується в об'ємному аналізі
Під час проведення лабораторних робіт використовують вимірювальний посуд:
мірні колби, піпетки (градуйовані та піпетки Мора), бюретки, мірні циліндри та мірні пробірки.
розраховані різні обсяги. На горлі колби є кільцева мітка, а на колбі вказана її ємність в мілілітрах при певній температурі.
Заповнення мірних колб виробляють через вирву. Останні порції розчинника повільно доливають до суміщення нижнього краю меніска розчину з міткою на колбі.
Піпетки Мора (I) призначені для відмірювання певного об'єму розчину, вказаного на розширеній частині піпетки. Градуйованими піпетками (II) можна відмірювати задані кількості розчину. Для наповнення піпетки нижній кінець її опускають у рідину (на дно судини) та
розчин втягують за допомогою груші. Рідина набирають так, щоб вона піднялася на 2-3 см вище за мітку і закривають верхній отвір вказівним пальцем. Потім послаблюють тиск і рідина починає витікати з піпетки.
Коли нижній меніск рідини опиниться на рівні з міткою, вказівний

палець знову притискають. Потім вводять піпетку в колбу для титрування і дають
рідини стекти.
її застосовують для титрування та відмірювання точних обсягів розчинів. Вона зміцнюється вертикально в штативі та відлік поділів ведуть зверху донизу. Перед роботою бюретку промивають титрантом і заповнюють розчином вище нульового поділу. Потім розчин наповнюють нижню частину бюретки і встановлюють нижній меніск розчину на нульову позначку.
Мірні циліндри
використовують для приблизного виміру об'ємів розчинів.
Для відмірювання необхідного об'єму рідини її наливають у мірний циліндр доти, доки нижній меніск не досягне рівня потрібного поділу.
1.4. Правила оформлення лабораторного звіту
Результати лабораторного експерименту оформлюють у лабораторному журналі. Протокол кожної роботи починають із нової сторінки, вказуючи дату та назву роботи. Далі викладають мету роботи, завдання, теоретичні основи методу, попередні розрахунки, хід роботи, результати вимірювань, розрахунки, висновки. До звіту можуть бути внесені малюнки приладів,
таблиці даних, графіки одержаних залежностей. Якщо результати вимірів виявилися помилковими, викладач може вимагати
повторення роботи чи її частини. При цьому зроблені раніше записи залишаються в
1.5. Методи одержання хімічної інформації
Розглянутий навчальний матеріал необхідно використовувати для формування теоретичних та практичних уявлень про основи хімічних та фізико-хімічних методів аналізу, що застосовуються у клінічному біохімічному аналізі для діагностики нормальних та патологічних станів.
Методи та способи отримання хімічної інформації вивчає аналітична хімія. В даний час більшість аналітичних вимірювань проводиться фізико-хімічними (інструментальними) методами:
оптичними, електрохімічними, хроматографічними. Однак для певних досліджень використовують класичні хімічні методи.
Дослідження будь-якого об'єкта включає ідентифікацію речовин
(Встановлення хімічної природи компонентів) та визначення їх кількісного змісту (маси, масової частки і т.д.). Тому в аналітичній хімії виділяють якісний та кількісний аналізи.
Сучасні фізико-хімічні методи аналізу дозволяє одночасно визначати якісний та кількісний склад.
Принципи якісного аналізу.
Ідентифікація органічних сполук проводиться з допомогою реакцій, притаманних певних функціональних груп. Аналіз неорганічних речовин проводиться роздільно за катіонами та аніонами з використанням реакцій, що супроводжуються аналітичними ефектами – виділенням газу або осаду, зміною кольору тощо. :
Fe3+ + 6 NCS- → 3-
Принципи кількісного аналізу.
У кількісному аналізі розрізняють хімічні, фізико-хімічні та фізичні методи.
Хімічні методизасновані на проведенні реакцій між зразком, що визначається, і спеціально підібраним реагентом. За кількістю витрачених реагентів або за кількістю отриманих продуктів реакції розраховують вміст речовини, що аналізується. Розрізняють гравіметричний (ваговий) та титриметричний (об'ємний) методи аналізу.
Гравіметричний аналіззаснований на кількісному виділенні компонента з аналізованої проби та його точному зважуванні. Цей аналіз дає точні результати, але трудомісткий та витісняється іншими методами аналізу.
Титриметричний аналізполягає в точному вимірі об'єму розчину хімічного реагенту, необхідного для завершення реакції з речовиною, що міститься в пробі, що вивчається. Цей вид аналізу широко застосовується в клінічних лабораторіях для аналізу крові, сечі,
шлункового соку і т.д.
Фізико-хімічніМетоди аналізу засновані на вивченні кількісної залежності між складом та фізичними властивостями об'єкта. У цих методах застосовують складну та чутливу апаратуру, їх перевагами є об'єктивність, можливість автоматизації та висока швидкість отримання результатів.
Крім того, хімічні та фізико-хімічні методи аналізу класифікують залежно від маси аналізованих проб.
Наприклад, у макрометоді проба становить 0,1-10 г,
у напівмікро – 0,01-0,1 г,
у мікро - 0,001-0,01 р.
Федеральне агентство з освіти Томський державний архітектурно-будівельний університет
І.А. КУРЗІНА, Т.С. ШЕПЕЛЕНКО, Г.В. ЛЯМІНА, І.А. БОЖКО, Є.А. ВАЙТУЛЕВИЧ
ЛАБОРАТОРНИЙ ПРАКТИКУМ З ЗАГАЛЬНОЇ ТА НЕОРГАНІЧНОЇ ХІМІЇ
Навчальний посібник
Видавництво Томського державного архітектурно-будівельного університету
УДК 546 (076.5) Л 12
Лабораторний практикум із загальної та неорганічної хімії [Текст]: навчальний посібник / І.А. Курзіна, Т.С. Шепеленко, Г.В. Ляміна [та ін.]; під. ред. І.А. Курзиною.
Томськ: Вид-во Том. держ. архіт.-будує. ун-ту, 2006. - 101 с. – ISBN 5–93057–172–4
У навчальному посібнику наводяться теоретичні відомості з основних розділів курсу загальної
і неорганічної хімії (класи неорганічних сполук, основні закони та поняття хімії, енергетичні ефекти хімічних реакцій, хімічна кінетика, розчини, електрохімія, основні властивості деяких елементів І – VII груп періодичної системи Д.І. Менделєєва). В експериментальній частині описано методики виконання сімнадцяти лабораторних робіт. Посібник дозволить студентам ефективніше готуватися до практичних занять та економити час при оформленні звітів з лабораторних робіт. Навчальний посібник призначений всім спеціальностей всіх форм навчання.
Ілл. 14, табл. 49, бібліогр. 9 назв Друкується за рішенням редакційно-видавничої ради ТДАСУ.
Рецензенти:
Доцент кафедри аналітичної хімії ХФ ТГУ, к.х.н. В.В. Шовковніков Доцент кафедри загальної хімії ТПУ, к.х.н. Г.А. Воронова Доцент кафедри хімії ТДАСУ, к.б.н. Т.М. Южакова
університет, 2006
Вступ............................... |
||||
Правила роботи у хімічній лабораторії............................................. ................... |
||||
Лабораторна робота №1. Класи неорганічних сполук................................... |
||||
Лабораторна робота №2. Визначення молекулярної маси кисню................... |
||||
Лабораторна робота №3.Визначення теплового ефекту хімічної реакції. |
||||
Лабораторна робота №4. Кінетика хімічних реакцій............................................ |
||||
Лабораторна робота №5.Визначення концентрації розчину. Жорсткість води... |
||||
Лабораторна робота №6.Реакції у розчинах електролітів. Гідроліз солей......... |
||||
Лабораторна робота №7. Електрохімічні процеси............................................. |
||||
Лабораторна робота №8. Хімічні властивості металів. Корозія........................ |
||||
Лабораторна робота №9. Алюміній та його властивості.................................................... |
||||
Лабораторна робота №10. Кремній. Гідравлічні в'яжучі................................. |
||||
Лабораторна робота №11. З'єднання азоту та фосфору............................................. |
||||
Лабораторна робота №12. Сірка та її властивості............................................................... |
||||
Лабораторна робота №13. Елементи підгрупи хрому.............................................. |
||||
Лабораторна робота № 14. Галогени ............................................ .................................. |
||||
Лабораторна робота №15. Елементи підгрупи марганцю......................................... |
||||
Лабораторна робота №16. Підгрупа сімейства заліза............................................. |
||||
Висновок................................................. .................................................. ........................ |
||||
Додаток 1. Список найважливіших кислот........................................................................ |
||||
Додаток 2. Характеристика кислотно-основнихіндикаторів ................................. |
||||
Додаток 3. Найважливіші фізико-хімічнівеличини ............................................. |
||||
Додаток 4. Найважливіші фізико-хімічніконстанти ........................................... |
||||
Додаток 5. Співвідношення між одиницями вимірів........................................... |
||||
Додаток 6. Приставки кратних та дольних одиниць.................................................... |
||||
Додаток 7. Кріоскопічні та ебуліоскопічні константи деяких рас- |
||||
творців ................................................. .................................................. ........................... |
||||
Додаток 8. |
електролітичної дисоціації (α) найважливіших |
|||
електрлітів у 0,1 н розчинах при 25 °С............................................................................. |
||||
Додаток 9. |
Константи |
дисоціації |
деяких електролітів у водних |
|
розчинах при 25 °С............................................................................................................... |
||||
Додаток 10. |
розчинності |
неорганічних сполук при |
||
кімнатній температурі......................................................................................................... |
||||
Додаток 11. Електрохімічний ряд напруг та стандартні електродні |
||||
потенціали за 25 °С........................................................................................................... |
||||
Додаток 12. Процеси, що протікають під час електролізу водних розчинів |
||||
солей ................................................. .................................................. ..................................... |
||||
Додаток 13. Періодична система елементів Д.І. Менделєєва .......................... |
||||
ВСТУП
Хімія відноситься до природничих наук, які вивчають навколишній матеріальний світ. Матеріальні об'єкти, що є предметом вивчення хімії, – це хімічні елементи та їх різноманітні сполуки. Усі об'єкти матеріального світу перебувають у безперервному русі (зміні). Існують різні форми руху матерії, зокрема хімічна форма руху, що також є предметом вивчення хімії. До хімічної форми руху матерії відносяться різноманітні хімічні реакції (перетворення речовин). Отже, хімія – це наука про властивості хімічних елементів та їх сполук та про закономірності перетворень речовин.
Найважливішим прикладним аспектом сучасної хімії є цілеспрямований синтез сполук, що мають необхідні та заздалегідь передбачені властивості, для подальшого їх застосування в різних галузях науки і техніки, зокрема для отримання унікальних матеріалів. Слід зазначити, що хімія як наука пройшла донині короткий шлях – приблизно починаючи з 1960-х років ХІХ століття. За період, що тривав півтора століття, розроблено періодичну класифікацію хімічних елементів та вчення про періодичність, створено теорію будови атома, теорію хімічного зв'язку та будову хімічних сполук, з'явилися такі важливі для опису хімічних процесів дисципліни, як хімічна термодинаміка та хімічна кінетика. радіохімія, ядерна фізика. Хімічні дослідження розширилися так, що окремі галузі хімії – неорганічна хімія, органічна хімія, аналітична хімія, фізична хімія, хімія полімерів, біохімія, агрохіміята ін – стали само-
незалежними науками.
Цей навчально-методичний посібник включає два основні розділи сучасної хімії: «Загальна хімія» та «Неорганічна хімія». Теоретичні основи розуміння різноманітної і складної картини хімічних явищ закладає загальна хімія. Неорганічна хімія вводить у конкретний світ речовин, що утворюються хімічними елементами. Автори прагнули у якомога коротшій формі висвітлити основні питання курсу загальної хімії. Значну увагу приділено теоретичним розділам загальної хімії: основні закони та поняття хімії, хімічна термодинаміка, хімічна кінетика, властивості розчинів, електрохімія. У розділі «Неорганічна хімія» розглянуто основні властивості елементів І – VІІ груп періодичної системи Д.І. Менделєєва. У додатках наведено основні фізико-хімічні властивості неорганічних речовин. Даний навчально-методичний посібник покликаний допомогти студентам у освоєнні основних положень хімії, придбанні навичок вирішення типових завдань та проведенні експериментів у хімічній лабораторії.
При проведенні лабораторних робіт дуже важливо дотримуватися техніки безпеки. Роботу з цим навчально-методичним посібником слід розпочинати зі знайомства з основними правилами роботи у хімічній лабораторії.
ПРАВИЛА РОБОТИ У ХІМІЧНІЙ ЛАБОРАТОРІЇ
Вимоги безпеки перед початком роботи:
1. Перед виконанням лабораторної роботи необхідно ознайомитися з фізикотехнічними властивостями речовин, що застосовуються та утворюються в процесі хімічної реакції, а також з інструкціями та правилами щодо поводження з ними.
2. Утримувати робоче місце у чистоті та порядку. На робочому столі повинні знаходитися тільки необхідні прилади та робочий зошит.
Вимоги безпеки під час роботи:
1. Приступати до виконання досвіду слід лише тоді, коли чітко з'ясовано мету та завдання його, коли обдумано окремі етапи виконання досвіду.
2. Роботи з отруйними, леткими та їдкими речовинами необхідно проводити тільки у витяжній шафі.
3. При всіх роботах дотримуватись максимальної обережності, пам'ятаючи, що неакуратність
і неуважність можуть спричинити нещасний випадок.
4. Не слід нахилятися над судиною з окропом. Пробірку, що нагрівається, необхідно тримати отвором від себе, так як може статися викид рідини. Прогрівати вміст по всій пробірці, а не лише знизу.
5. Після використання реактиву його необхідно відразу ставити на місце, щоб не створювати безладдя на робочому місці і не переплутати реактиви під час розміщення їх наприкінці занять.
6. При розведенні концентрованої сірчаної кислоти необхідно вливати кислоту малими порціями у воду, а не навпаки.
7. Забороняється працювати з вогненебезпечними речовинами поблизу включених електроприладів і спиртівок або пальників, що горять.
8. Нюхати речовину слід, направляючи пари до себе рухом руки, а не вдихаючи їх на повні груди.
9. Не можна вживати для дослідів речовину з банок, упаковок та крапельниць без етикеток або з нерозбірливими написами.
10. При попаданні на шкіру кислоти або лугу необхідно промити обпалене місце великою кількістю води, а потім при опіках кислотою. 3% розчином соди, а при опіках лугами - 1% розчином борної кислоти.
11. При попаданні реактиву у вічі слід промити їх струменем води, а при отруєнні газами забезпечити постраждалому приплив свіжого повітря.
12. Щоб уникнути отруєнь, категорично забороняється зберігати та вживати їжу, курити у робочих кімнатах хімічних лабораторій.
Вимоги безпеки після закінчення роботи:
Необхідно прибирати зі столу та підлоги все пролите, розбите та розсипане. Після виконання експерименту, робоче місце необхідно упорядкувати. Гранули та шматочки металу не кидати у раковину, а складати у спеціальну посудину та здавати лаборанту. Жодних речовин з лабораторії не можна брати додому. Після закінчення роботи потрібно обя-
тщательно вимити руки.Про всі порушення правил техніки безпеки та непередбачені ситуації негайно повідомляти викладача!
З правилами техніки безпеки ознайомився та зобов'язуюсь виконувати Підпис студента:
Інструктаж провів, знання правил техніки безпеки перевірив Підпис викладача:

Лабораторна робота №1
КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Мета роботи: вивчити класи неорганічних сполук, способи їх отримання та хімічні властивості.
Теоретична частина
Усі хімічні речовини ділять на дві групи: прості та складні. Прості речовинискладаються з атомів одного елемента (Cl2, O2, С та ін). До складу складних входять два або більше елементів (K2 SO4, NaOH, HNO3 та ін.). Найважливішими класами неорганічних сполук є оксиди, гідроксиди та солі (рисунок).
Оксидами називаються сполуки, які з двох елементів, одне із яких кисень. За функціональними ознаками оксиди поділяються на солеутворюючі та несолетворні (байдужі). Несолетворниминазиваються оксиди, які не утворюють гідратних сполук та солей (CO, NO, N2 O). Солеутворюючі оксидиза хімічними властивостями поділяють на основні , кислотні та амфотерні (рисунок). Хімічні властивості оксидів представлені у табл. 1.
Na2 O; MgO; CuO.
Кислотні оксидиутворюють всі неметали (крім F) і метали з високим ступенем окиснення (+5, +6, +7), наприклад SO3; P2 O5; Mn2 O7; CrO3.
Амфотерні оксидиутворюють деякі метали в ступені окислення +2 (Be, Zn, Sn, Pb) та майже всі метали в ступені окислення +3 та +4 (Al, Ga, Sc, Ge, Sn, Pb, Cr, Mn).
Таблиця 1
Хімічні властивості оксидів
Основні оксиди |
Кислотні оксиди |
||
Основний оксид + H2 O → Основа |
Кислотний оксид + H2 O → Кислота |
||
CaO+H2O → Ca(OH)2 |
SO3 + H2 O → H2 SO4 |
||
основ. оксид + Кисл. оксид → Сіль |
Кисл. оксид + Основний оксид → Сіль |
||
CaO+CO2 → CaCO3 |
SO3 + Na2 O → Na2 SO4 |
||
основ. оксид + Кислота → Сіль + H2 O |
Кисл. оксид + Основа → Сіль + H2 O |
||
CaO+H2 SO4 → CaSO4 +H2 O |
SO3 + 2NaOH → Na2 SO4 + H2 O |
Амфотерні оксиди
1. Амфотерний оксид + H 2 O →
2. Амф. оксид + Кисл. оксид → Сіль 2. Амф. оксид + Основний оксид → Сіль
ZnO + N2 O5 → Zn(NO3 )2 |
ZnO2 + Na2 O → Na2 ZnO2 (у розплаві) |
3. Амф. оксид + Кислота → Сіль + H2O 3. Амф. оксид + Основа → Сіль + H2 O |
|
ZnO + H2 SO4 → ZnSO4 + H2 O |
ZnO+2NaOH → Na2 ZnO2 +H2O (у розплаві) |
ZnO+2NaOH 2 → Na2 (у розчині) |
|

НЕОРГАНІЧНІ СПОЛУКИ |
||||
Основні |
||||
IA: Li, Na, K, Rb, Cs |
Me2 O (Me = Li, Na, K, Rb, Cs) |
|||
IIA: Mg, Ca, Sr, Ba |
MeO (Me = Mg, Ca, Sr, Ba, Cu, Ni) |
|||
АМФОТЕРНІ |
Солеутворюючі |
Амфотерні |
||
EO (E = Be, Zn, Sn, Pb) |
||||
E2 O3 (E = Al, Ga, Cr) |
||||
EO2 (E = Ge, Pb) |
||||
Кислотні |
||||
Cl2 O |
||||
EO2 (E=S, Se, C, Si) |
||||
БЛАГОРОДНІ |
E2 O3 (E=N, As) |
|||
E2 O5 (E = N, P, As, I) |
||||
EO3 (E = S, Se) |
||||
VIIIA: He, Ne, Ar |
||||
Несолетворні |
||||
CO, NO, N2O, SiO, S2O |
||||
НЕМЕТАЛИ |
||||
Основні (підстави) |
||||
VA: N2, P, As |
||||
VIA: O2, S, Se |
MeOH (Me = Li, Na, K, Rb, Cs) |
|||
VIIA: F2, Cl2, Br2, I2 |
Me(OH)2 (Me=Mg, Ca, Sr, Ba, Cu, Ni) |
|||
Амфотерні |
||||
E(OH)2 (E=Be, Zn, Sn, Pb) |
||||
E(OH)3 (E=Al, Cr) |
||||
ГІДРОКСИДИ |
Кислотні (кислоти) |
|||
Кисень- |
Безкисло- |
|||
HEO2 (E=N, As) |
(E=F, Cl, Br, I) |
|||
H3 AsO3 |
||||
H2 EO3 (E=Se, C) |
||||
HEO3 (E=N, P, I) |
||||
H3 EO4 (E=P, As) |
||||
H2 EO4 (E=S, Se, Cr) |
||||
HEO4 (E=Cl, Mn) |
||||
Основні солі (гідроксосолі) |
||||
FeOH(NO3 )2 , (CaOH)2 SO4 |
||||
Середні солі (нормальні) |
||||
Na2 С3, Mg(NO3)2, Ca3(PO4)2 |
||||
Кислі солі (гідросолі) |
||||
NaHSO4, KHSO4, CaH2 (PO4)2 |
||||
Класифікація неорганічних сполук |
||||

Гідроксидами називають хімічні сполуки оксидів із водою. За хімічними властивостями розрізняють основні гідроксиди, кислотні гідроксиди та амфотерні гідроксиди (див. рисунок). Основні хімічні властивості гідроксидів наведено у табл. 2.
Основними гідроксидамиабо основами називають речовини, які при електролітичній дисоціації у водних розчинах утворюють негативно заряджені гідроксидіони (OH-) та інших негативних іонів не утворюють. Добре розчинні у воді гідроксиди лужних металів, крім LiOH, отримали назву лугів. Назви основних гідроксидів утворюються зі слова «гідроксід» та назви елемента в родовому відмінку, після якого, у разі потреби, римськими цифрами в дужках вказується ступінь окисленості елемента. Наприклад, Fe(OH)2 – гідроксид заліза (II).
Кислотними гідроксидамиабо кислотами називають речовини, які при дисоціації у водних розчинах утворюють позитивно заряджені іони водню (H+) та інших позитивних іонів не утворюють. Назви кислотних гідроксидів (кислот) утворюються за правилами, встановленими для кислот (див. дод. 1)
Амфотерні гідроксидиабо амфоліти утворені елементами з властивостями амфотер. Амфотерні гідроксиди називають подібно до основних гідроксидів, наприклад, Al(OH)3 – гідроксид алюмінію. Амфоліти виявляють як кислотні, і основні властивості (табл. 2).
Таблиця 2
Хімічні властивості гідроксидів
Основи |
|||
to C |
|||
Основа → Основний оксид + H2 O |
|||
to C |
|||
Ba(OH)2 → BaO + H2 O |
|||
Основа + Кисл. оксид → Сіль + H2 O |
2. Кислота + осн. оксид →Сіль+ H2 O |
||
Ba(OH)2 + CO2 → BaCO3 + H2 O |
H2 SO4 + Na2 O → Na2 SO4 + H2 O |
||
3. Основа + Кислота → Сіль + H 2 O
Ba(OH)2 + H2 SO4 → BaSO4 + 2H2 O
Амфотерні гідроксиди
1. Амф. гідроксид+Кисл. оксид→Сіль+H2O 1. Амф. гідроксид+Осн. оксид → Сіль+H2 O
Солі – це речовини, молекули яких складаються з катіонів металу та кислотного залишку. Їх можна розглядати як продукти часткового або повного заміщення водню в кислоті на метал або гідроксидних груп в основі кислотних залишків.
Розрізняють середні, кислі та основні солі (див. малюнок). Середні або нормальні солі - продукти повного заміщення атомів водню в кислотах на метал або гідроксидних груп в основі кислотного залишку. Кислі солі – продукти неповного заміщення атомів водню у молекулах кислот іонами металів. Основні солі – продукти неповного заміщення гідроксидних груп у основах на кислотні залишки.

Назви середніх солей складають із назви аніону кислоти в називному відмінку (додаток 1) та назви катіону у родовому відмінку, наприклад CuSO4 – сульфат міді. Назву кислих солей утворюють так само, як і середніх, але при цьому додають приставку гідро-, що вказує на наявність незаміщених атомів водню, число яких позначають грецькими числівниками, наприклад, Ba(H2 PO4 )2 – дигідрофосфат барію. Назви основних солей також утворюють подібно до назв середніх солей, але при цьому додають приставку гідроксо-, що вказує на наявність незаміщених гідроксогруп, наприклад, Al(OH)2 NO3 – дигидроксонитрат алюмінію.
Порядок виконання роботи
Досвід 1. Встановлення характеру оксидів
Досвід 1.1. Взаємодія оксиду кальцію з водою (А), соляною кислотою (Б), їдким натром (В). Середовище отриманого розчину в досвіді (А) перевірити за допомогою індикатора
(Додаток 2).
Спостереження: А.
Рівняння реакцій:
Досвід 1.2. Взаємодія оксиду бору з водою (А), соляною кислотою (Б), їдким натром (В). Досвід (А) проводити під час нагрівання.Середовище отриманого розчину в досвіді (А) перевірити за допомогою індикатора (додаток 2).
Спостереження: А.
Рівняння реакцій:
Досвід 2 . Одержання та властивості гідроксиду алюмінію
Досвід 2.1. Взаємодія хлориду алюмінію з нестачею гідроксиду натрію