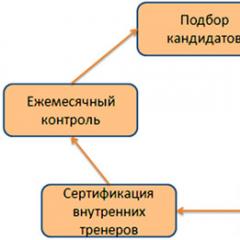
نمونه های پیوند شیمیایی کووالانسی پیوند کووالانسی - قطبی و غیر قطبی، مکانیسم های تشکیل
اتم های اکثر عناصر به طور جداگانه وجود ندارند، زیرا می توانند با یکدیگر تعامل داشته باشند. در این برهمکنش ذرات پیچیده تری تشکیل می شوند.
ماهیت پیوند شیمیایی عمل نیروهای الکترواستاتیکی است که نیروهای برهمکنش بین بارهای الکتریکی هستند. الکترون ها و هسته های اتم چنین بارهایی دارند.
الکترونهایی که در سطوح الکترونیکی بیرونی (الکترونهای ظرفیتی) قرار دارند، که دورترین آنها از هسته هستند، ضعیفترین برهمکنش را با آن دارند و بنابراین میتوانند از هسته جدا شوند. آنها مسئول اتصال اتم ها به یکدیگر هستند.
انواع برهمکنش در شیمی
انواع پیوندهای شیمیایی را می توان به صورت جدول زیر نشان داد:
ویژگی پیوند یونی
 فعل و انفعالات شیمیایی که به دلیل جاذبه یونیداشتن بارهای مختلف یونی نامیده می شود. این در صورتی اتفاق میافتد که اتمهای پیوند خورده تفاوت قابلتوجهی در الکترونگاتیوی داشته باشند (یعنی توانایی جذب الکترونها) و جفت الکترون به عنصر الکترونگاتیوتری برود. نتیجه چنین انتقال الکترون ها از یک اتم به اتم دیگر، تشکیل ذرات باردار - یون ها است. جاذبه ای بین آنها وجود دارد.
فعل و انفعالات شیمیایی که به دلیل جاذبه یونیداشتن بارهای مختلف یونی نامیده می شود. این در صورتی اتفاق میافتد که اتمهای پیوند خورده تفاوت قابلتوجهی در الکترونگاتیوی داشته باشند (یعنی توانایی جذب الکترونها) و جفت الکترون به عنصر الکترونگاتیوتری برود. نتیجه چنین انتقال الکترون ها از یک اتم به اتم دیگر، تشکیل ذرات باردار - یون ها است. جاذبه ای بین آنها وجود دارد.
کمترین الکترونگاتیوی را دارند فلزات معمولیو بزرگترین آنها غیر فلزات معمولی هستند. بنابراین یون ها از برهمکنش بین فلزات معمولی و غیر فلزات معمولی تشکیل می شوند.
اتمهای فلزات به یونهای با بار مثبت (کاتیونها) تبدیل میشوند و الکترونها را به سطوح الکترونیکی خارجی اهدا میکنند و غیرفلزات الکترونها را میپذیرند و در نتیجه تبدیل به دارای بار منفییون ها (آنیون ها).
اتم ها به حالت انرژی پایدارتر حرکت می کنند و پیکربندی های الکترونیکی خود را تکمیل می کنند.
پیوند یونی غیر جهت دار و غیر اشباع است، زیرا برهمکنش الکترواستاتیکی به ترتیب در همه جهات رخ می دهد، یون می تواند یون های علامت مخالف را در همه جهات جذب کند.
آرایش یون ها به گونه ای است که در اطراف هر یک قرار دارد تعداد معینیون های با بار مخالف مفهوم "مولکول" برای ترکیبات یونی معنی ندارد.
نمونه هایی از آموزش و پرورش
 تشکیل پیوند در کلرید سدیم (nacl) به دلیل انتقال الکترون از اتم Na به اتم Cl با تشکیل یونهای مربوطه است:
تشکیل پیوند در کلرید سدیم (nacl) به دلیل انتقال الکترون از اتم Na به اتم Cl با تشکیل یونهای مربوطه است:
Na 0 - 1 e \u003d Na + (کاتیون)
Cl 0 + 1 e \u003d Cl - (آنیون)
در کلرید سدیم، شش آنیون کلرید در اطراف کاتیون های سدیم و شش یون سدیم در اطراف هر یون کلرید وجود دارد.
هنگامی که یک برهمکنش بین اتم ها در سولفید باریم ایجاد می شود، فرآیندهای زیر رخ می دهد:
Ba 0 - 2 e \u003d Ba 2+
S 0 + 2 e \u003d S 2-
Ba دو الکترون خود را به گوگرد اهدا می کند و در نتیجه آنیون های گوگرد S 2- و کاتیون های باریم Ba 2 + تشکیل می شود.
پیوند شیمیایی فلزی
 تعداد الکترون ها در سطوح انرژی بیرونی فلزات کم است و به راحتی از هسته جدا می شوند. در نتیجه این جدا شدن، یون های فلزی و الکترون های آزاد تشکیل می شوند. این الکترون ها «گاز الکترون» نامیده می شوند. الکترونها آزادانه در سراسر حجم فلز حرکت میکنند و دائماً از اتمها متصل و جدا میشوند.
تعداد الکترون ها در سطوح انرژی بیرونی فلزات کم است و به راحتی از هسته جدا می شوند. در نتیجه این جدا شدن، یون های فلزی و الکترون های آزاد تشکیل می شوند. این الکترون ها «گاز الکترون» نامیده می شوند. الکترونها آزادانه در سراسر حجم فلز حرکت میکنند و دائماً از اتمها متصل و جدا میشوند.
ساختار ماده فلزی به شرح زیر است: شبکه کریستالی ستون فقرات ماده است و الکترون ها می توانند آزادانه بین گره های آن حرکت کنند.
نمونه های زیر را می توان بیان کرد:
Mg - 2e<->Mg2+
Cs-e<->Cs +
Ca-2e<->Ca2+
Fe-3e<->Fe3+
کووالانسی: قطبی و غیر قطبی
 رایج ترین نوع برهمکنش شیمیایی پیوند کووالانسی است. مقادیر الکترونگاتیوی عناصر متقابل به شدت متفاوت نیست، در ارتباط با این، تنها یک جابجایی جفت الکترون مشترک به یک اتم الکترونگاتیو تر رخ می دهد.
رایج ترین نوع برهمکنش شیمیایی پیوند کووالانسی است. مقادیر الکترونگاتیوی عناصر متقابل به شدت متفاوت نیست، در ارتباط با این، تنها یک جابجایی جفت الکترون مشترک به یک اتم الکترونگاتیو تر رخ می دهد.
برهمکنش کووالانسی می تواند توسط مکانیسم تبادل یا مکانیسم دهنده-گیرنده تشکیل شود.
مکانیسم تبادل در صورتی تحقق مییابد که هر یک از اتمها دارای الکترونهای جفت نشده در سطوح الکترونیکی بیرونی باشند و همپوشانی اوربیتالهای اتمی منجر به ظهور یک جفت الکترون شود که قبلاً به هر دو اتم تعلق دارد. هنگامی که یکی از اتم ها دارای یک جفت الکترون در سطح الکترونیکی بیرونی است و دیگری دارای یک اوربیتال آزاد است، آنگاه هنگامی که اوربیتال های اتمی همپوشانی دارند، جفت الکترون اجتماعی می شود و برهمکنش بر اساس مکانیسم دهنده-پذیرنده رخ می دهد.
کووالنت ها بر اساس تعدد به دو دسته تقسیم می شوند:
- ساده یا مجرد؛
- دو برابر؛
- سه گانه.
دوتایی ها اجتماعی شدن دو جفت الکترون را به طور همزمان و سه برابر - سه فراهم می کنند.
با توجه به توزیع چگالی الکترون (قطبی) بین اتم های پیوندی، پیوند کووالانسی به موارد زیر تقسیم می شود:
- غیر قطبی؛
- قطبی
یک پیوند غیر قطبی توسط اتم های یکسان و یک پیوند قطبی با الکترونگاتیوی متفاوت تشکیل می شود.
 برهمکنش اتم هایی با الکترونگاتیوی مشابه را پیوند غیرقطبی می گویند. جفت الکترون های مشترک در چنین مولکولی به هیچ یک از اتم ها جذب نمی شود، اما به طور مساوی به هر دو تعلق دارد.
برهمکنش اتم هایی با الکترونگاتیوی مشابه را پیوند غیرقطبی می گویند. جفت الکترون های مشترک در چنین مولکولی به هیچ یک از اتم ها جذب نمی شود، اما به طور مساوی به هر دو تعلق دارد.
برهمکنش عناصر متفاوت در الکترونگاتیوی منجر به تشکیل پیوندهای قطبی می شود. جفت الکترون های معمولی با این نوع برهمکنش توسط عنصر الکترونگاتیو تری جذب می شوند، اما به طور کامل به آن منتقل نمی شوند (یعنی تشکیل یون ها اتفاق نمی افتد). در نتیجه چنین تغییری در چگالی الکترون، بارهای جزئی روی اتم ها ظاهر می شود: در یک الکترونگاتیو بیشتر، یک بار منفی و در یک الکترونگاتیو کمتر، یک بار مثبت.
خواص و ویژگی های کووالانسی
ویژگی های اصلی پیوند کووالانسی:
- طول با فاصله بین هسته های اتم های متقابل تعیین می شود.
- قطبیت با جابجایی ابر الکترونی به یکی از اتم ها تعیین می شود.
- جهت گیری - خاصیت تشکیل پیوندهای فضاگرا و بر این اساس، مولکول هایی که اشکال هندسی خاصی دارند.
- اشباع با توانایی تشکیل تعداد محدودی پیوند تعیین می شود.
- قطبش پذیری با توانایی تغییر قطبیت تحت تأثیر میدان الکتریکی خارجی تعیین می شود.
- انرژی مورد نیاز برای شکستن یک پیوند، که استحکام آن را تعیین می کند.
 مولکول های هیدروژن (H2)، کلر (Cl2)، اکسیژن (O2)، نیتروژن (N2) و بسیاری دیگر می توانند نمونه ای از برهم کنش غیر قطبی کووالانسی باشند.
مولکول های هیدروژن (H2)، کلر (Cl2)، اکسیژن (O2)، نیتروژن (N2) و بسیاری دیگر می توانند نمونه ای از برهم کنش غیر قطبی کووالانسی باشند.
H+ + H → مولکول H-Hیک پیوند غیر قطبی دارد،
O: + :O → O=O مولکول دارای یک غیر قطبی دوگانه است،
Ṅ: + Ṅ: → N≡N مولکول دارای یک ناقطبی سه گانه است.
به عنوان نمونه هایی از پیوند کووالانسی عناصر شیمیایی، می توان مولکول های دی اکسید کربن (CO2) و گاز مونوکسید کربن (CO)، سولفید هیدروژن (H2S) را ذکر کرد. اسید هیدروکلریک(HCL)، آب (H2O)، متان (CH4)، اکسید گوگرد (SO2) و بسیاری دیگر.
در مولکول CO2، رابطه بین اتمهای کربن و اکسیژن قطبی کووالانسی است، زیرا هیدروژن الکترونگاتیو تر، چگالی الکترون را به سمت خود جذب میکند. اکسیژن در هر دو الکترون جفت نشده دارد سطح خارجیو کربن می تواند چهار الکترون ظرفیتی را برای تشکیل برهمکنش فراهم کند. در نتیجه پیوندهای دوگانه تشکیل می شود و مولکول به شکل زیر است: O=C=O.
برای تعیین نوع پیوند در یک مولکول خاص، کافی است اتم های تشکیل دهنده آن را در نظر بگیریم. مواد ساده فلزات فلزی، فلزات با غیر فلزات - یونی، مواد سادهغیر فلزات - کووالانسی غیرقطبی، و مولکول های متشکل از غیر فلزات مختلف از طریق یک پیوند قطبی کووالانسی تشکیل می شوند.
کووالانسی، یونی و فلزی سه نوع اصلی پیوندهای شیمیایی هستند.
بیایید بیشتر بدانیم پیوند شیمیایی کووالانسی. بیایید مکانیسم وقوع آن را در نظر بگیریم. بیایید شکل گیری یک مولکول هیدروژن را به عنوان مثال در نظر بگیریم:
یک ابر کروی متقارن که توسط یک الکترون 1s تشکیل شده است، هسته یک اتم هیدروژن آزاد را احاطه کرده است. وقتی اتمها تا فاصله معینی به یکدیگر نزدیک میشوند، اوربیتالهای آنها تا حدی همپوشانی دارند (شکل را ببینید).  در نتیجه، یک ابر مولکولی دو الکترونی بین مرکز هر دو هسته ظاهر می شود که دارای حداکثر چگالی الکترونی در فضای بین هسته است. با افزایش چگالی بار منفی، نیروی جاذبه بین ابر مولکولی و هسته افزایش می یابد.
در نتیجه، یک ابر مولکولی دو الکترونی بین مرکز هر دو هسته ظاهر می شود که دارای حداکثر چگالی الکترونی در فضای بین هسته است. با افزایش چگالی بار منفی، نیروی جاذبه بین ابر مولکولی و هسته افزایش می یابد.
بنابراین، می بینیم که یک پیوند کووالانسی با همپوشانی ابرهای الکترونی اتم ها تشکیل می شود که با آزاد شدن انرژی همراه است. اگر فاصله بین هسته اتم های نزدیک به لمس 0.106 نانومتر باشد، پس از همپوشانی ابرهای الکترونی 0.074 نانومتر خواهد بود. هرچه همپوشانی اوربیتال های الکترونی بیشتر باشد، پیوند شیمیایی قوی تر است.
کووالانسیتماس گرفت پیوند شیمیایی که توسط جفت الکترون انجام می شود. ترکیبات با پیوند کووالانسی نامیده می شوند هومیوپولاریا اتمی.
وجود دارد دو نوع پیوند کووالانسی: قطبیو غیر قطبی.
با غیر قطبی پیوند کووالانسی که توسط یک جفت الکترون مشترک ایجاد می شود، ابر الکترونی به طور متقارن با توجه به هسته های هر دو اتم توزیع می شود. یک مثال می تواند مولکول های دو اتمی باشد که از یک عنصر تشکیل شده اند: Cl 2، N 2، H 2، F 2، O 2 و سایرین، که در آنها جفت الکترون به طور مساوی به هر دو اتم تعلق دارد.
در قطب در پیوند کووالانسی، ابر الکترونی به سمت اتم با الکترونگاتیوی نسبی بالاتر جابهجا میشود. به عنوان مثال، مولکول های ترکیبات معدنی فرار مانند H 2 S، HCl، H 2 O و غیره.
شکل گیری مولکول HCl را می توان به صورت زیر نشان داد:
![]()
زیرا الکترونگاتیوی نسبی اتم کلر (2.83) بیشتر از اتم هیدروژن (2.1) است، جفت الکترون به سمت اتم کلر جابجا می شود.
علاوه بر مکانیسم تبادل برای تشکیل پیوند کووالانسی - به دلیل همپوشانی، نیز وجود دارد اهدا کننده - پذیرندهمکانیسم تشکیل آن این مکانیسمی است که در آن تشکیل یک پیوند کووالانسی به دلیل ابر دو الکترونی یک اتم (دهنده) و یک مدار آزاد اتم دیگر (پذیرنده) اتفاق میافتد. بیایید به مثالی از مکانیسم تشکیل آمونیوم NH 4 + نگاه کنیم. در مولکول آمونیاک، اتم نیتروژن دارای یک ابر دو الکترونی است:
یون هیدروژن دارای یک اوربیتال 1s آزاد است، بیایید آن را به صورت .
در فرآیند تشکیل یون آمونیوم، ابر دو الکترونی نیتروژن برای اتم های نیتروژن و هیدروژن رایج می شود، به این معنی که به یک ابر الکترونی مولکولی تبدیل می شود. بنابراین، پیوند کووالانسی چهارم ظاهر می شود. فرآیند تشکیل آمونیوم را می توان به صورت زیر نشان داد: 
بار یون هیدروژن بین همه اتم ها پراکنده می شود و ابر دو الکترونی که متعلق به نیتروژن است با هیدروژن مشترک می شود.
آیا هیچ سوالی دارید؟ نمی دانید چگونه تکالیف خود را انجام دهید؟
برای کمک گرفتن از یک معلم خصوصی - ثبت نام کنید.
درس اول رایگان است
سایت، با کپی کامل یا جزئی از مطالب، لینک به منبع الزامی است.
پیوند کووالانسی رایج ترین نوع پیوند شیمیایی است که هنگام برهمکنش با مقادیر الکترونگاتیوی یکسان یا مشابه ایجاد می شود.
پیوند کووالانسی پیوند بین اتم ها با استفاده از جفت الکترون مشترک است.
از زمان کشف الکترون، تلاش های زیادی برای توسعه یک نظریه الکترونیکی پیوند شیمیایی صورت گرفته است. موفقترین آنها کارهای لوئیس (1916) بود، که پیشنهاد کرد تشکیل پیوند را در نتیجه ظهور جفتهای الکترون مشترک بین دو اتم در نظر بگیرد. برای انجام این کار، هر اتم همان تعداد الکترون را فراهم می کند و سعی می کند اطراف خود را با یک هشت یا دوتایی از الکترون های مشخصه خارجی احاطه کند. پیکربندی الکترونیکیگازهای بی اثر از نظر گرافیکی، تشکیل پیوندهای کووالانسی به دلیل الکترون های جفت نشده طبق روش لوئیس با استفاده از نقاط نشان دهنده الکترون های بیرونی اتم به تصویر کشیده شده است.
تشکیل پیوند کووالانسی بر اساس نظریه لوئیس
مکانیسم تشکیل پیوند کووالانسی
علامت اصلی پیوند کووالانسی وجود یک جفت الکترون مشترک متعلق به هر دو اتم شیمیایی مرتبط است، زیرا حضور دو الکترون در میدان عمل دو هسته از نظر انرژی مطلوب تر از حضور هر الکترون در میدان است. هسته خودش ظهور یک جفت الکترون مشترک از پیوندها می تواند از طریق مکانیسم های مختلف، اغلب از طریق تبادل، و گاهی اوقات از طریق گیرنده دهنده انجام شود.
با توجه به اصل مکانیسم تبادل برای تشکیل پیوند کووالانسی، هر یک از اتمهای برهم کنش، تعداد یکسانی الکترون را با اسپینهای ضد موازی برای تشکیل پیوند تامین میکنند. برای مثال:
 طرح کلی برای تشکیل یک پیوند کووالانسی: الف) توسط مکانیسم تبادل. ب) با توجه به مکانیسم دهنده-پذیرنده
طرح کلی برای تشکیل یک پیوند کووالانسی: الف) توسط مکانیسم تبادل. ب) با توجه به مکانیسم دهنده-پذیرنده با توجه به مکانیسم دهنده-گیرنده، یک پیوند دو الکترونی در طول برهمکنش ذرات مختلف ایجاد می شود. یکی از آنها اهدا کننده است و:دارای یک جفت الکترون مشترک (یعنی یکی که فقط به یک اتم تعلق دارد) و دیگری یک گیرنده است. ATاوربیتال خالی دارد
ذره ای که یک پیوند دو الکترونی (یک جفت الکترون مشترک) ایجاد می کند، دهنده و ذره ای با اوربیتال آزاد که این جفت الکترون را می پذیرد، گیرنده نامیده می شود.
مکانیسم تشکیل پیوند کووالانسی به دلیل ابر دو الکترونی از یک اتم و یک مدار خالی اتم دیگر مکانیسم دهنده - گیرنده نامیده می شود.
پیوند دهنده-پذیرنده نیمه قطبی نامیده می شود، زیرا یک بار مثبت جزئی δ+ روی اتم دهنده ایجاد می شود (به دلیل این واقعیت که جفت الکترون های تقسیم نشده آن از آن منحرف شده است)، و یک بار منفی موثر جزئی δ- بر روی اتم ایجاد می شود. اتم پذیرنده (به دلیل این واقعیت است که در جهت آن جابجایی جفت الکترون تقسیم نشده دهنده وجود دارد).
نمونه ای از اهداکننده جفت الکترون ساده یون H است. — ، که دارای یک جفت الکترون مشترک نیست. در نتیجه افزودن یک یون هیدرید منفی به مولکولی که اتم مرکزی آن دارای اوربیتال آزاد است (به عنوان یک سلول کوانتومی خالی در نمودار نشان داده شده است)، به عنوان مثال، ВН 3، یک یون پیچیده پیچیده ВН 4 تشکیل می شود. — با بار منفی (N — + VN 3 ⟶⟶ [VN 4] -):

گیرنده جفت الکترون یک یون هیدروژن یا به سادگی یک پروتون H + است. اتصال آن به مولکولی که اتم مرکزی آن دارای یک جفت الکترون مشترک است، به عنوان مثال، به NH 3، همچنین منجر به تشکیل یک یون پیچیده NH 4 +، اما با بار مثبت می شود:

روش باند ظرفیت
اولین نظریه مکانیک کوانتومی پیوند کووالانسیتوسط هایتلر و لندن (در سال 1927) برای توصیف مولکول هیدروژن ایجاد شد و سپس توسط Pauling برای مولکول های چند اتمی استفاده شد. این نظریه نامیده می شود روش باند ظرفیتیکه مهمترین نکات آن را می توان به شرح زیر خلاصه کرد:
- هر جفت اتم در یک مولکول توسط یک یا چند جفت الکترون مشترک، با اوربیتالهای الکترونی اتمهای برهمکنش همپوشانی دارند.
- استحکام پیوند به درجه همپوشانی اوربیتال های الکترونی بستگی دارد.
- شرط تشکیل پیوند کووالانسی ضد جهت اسپین های الکترون است. به همین دلیل، یک اوربیتال الکترونی تعمیم یافته با بیشترین چگالی الکترون در فضای بین هسته ای ایجاد می شود که جذب هسته های با بار مثبت به یکدیگر را تضمین می کند و با کاهش انرژی کل سیستم همراه است.
هیبریداسیون اوربیتال های اتمی
علیرغم اینکه الکترون های اوربیتال های s، p یا d که دارای اشکال مختلف و جهت گیری های متفاوت در فضا هستند، در تشکیل پیوندهای کووالانسی شرکت می کنند، در بسیاری از ترکیبات این پیوندها معادل هستند. برای توضیح این پدیده، مفهوم «هیبریداسیون» معرفی شد.
هیبریداسیون فرآیند اختلاط و تراز کردن اوربیتالها از نظر شکل و انرژی است که در آن چگالی الکترونی اوربیتالهای با انرژیهای مشابه دوباره توزیع میشود و در نتیجه معادل میشوند.
مفاد اصلی تئوری هیبریداسیون:
- در طول هیبریداسیون، شکل اولیه و اوربیتالها متقابلاً تغییر میکنند، در حالی که اوربیتالهای هیبرید شده جدید تشکیل میشوند، اما با همان انرژی و همان شکل، شبیه شکل نامنظم هشت.
- تعداد اوربیتال های هیبرید شده برابر با تعداد اوربیتال های خروجی درگیر در هیبریداسیون است.
- اوربیتالهایی با انرژیهای مشابه (اوربیتالهای s و p سطح انرژی بیرونی و اوربیتالهای d سطح خارجی یا مقدماتی) میتوانند در هیبریداسیون شرکت کنند.
- اوربیتال های هیبرید شده در جهت تشکیل پیوندهای شیمیایی کشیده تر هستند و بنابراین همپوشانی بهتری با اوربیتال های اتم همسایه ایجاد می کنند و در نتیجه از اوربیتال های غیر هیبریدی منفرد تشکیل شده در اثر الکترون ها قوی تر می شود.
- با توجه به تشکیل پیوندهای قوی تر و توزیع متقارن تر چگالی الکترون در مولکول، یک بهره انرژی به دست می آید که بیش از آن انرژی مصرفی مورد نیاز برای فرآیند هیبریداسیون را جبران می کند.
- اوربیتال های هیبرید شده باید به گونه ای در فضا جهت گیری شوند که حداکثر جدایی متقابل از یکدیگر را تضمین کنند. در این حالت، انرژی دافعه کوچکترین است.
- نوع هیبریداسیون بر اساس نوع و تعداد اوربیتال های خروجی تعیین می شود و اندازه زاویه پیوند و همچنین پیکربندی فضایی مولکول ها را تغییر می دهد.
 شکل اوربیتال های هیبرید شده و زوایای ظرفیت (زوایای هندسی بین محورهای تقارن اوربیتال ها) بسته به نوع هیبریداسیون: الف) هیبریداسیون sp. ب) هیبریداسیون sp 2. ج) هیبریداسیون sp 3
شکل اوربیتال های هیبرید شده و زوایای ظرفیت (زوایای هندسی بین محورهای تقارن اوربیتال ها) بسته به نوع هیبریداسیون: الف) هیبریداسیون sp. ب) هیبریداسیون sp 2. ج) هیبریداسیون sp 3 در طول تشکیل مولکول ها (یا تکه های جداگانه مولکول ها)، انواع زیر هیبریداسیون اغلب رخ می دهد:
 طرح کلی هیبریداسیون sp
طرح کلی هیبریداسیون sp پیوندهایی که با مشارکت الکترون های اوربیتال های هیبرید شده sp تشکیل می شوند نیز در زاویه 180 0 قرار می گیرند که منجر به شکل خطی مولکول می شود. این نوع هیبریداسیون در هالیدهای عناصر گروه دوم (Be، Zn، Cd، Hg) مشاهده می شود که اتم های آنها در حالت ظرفیت دارای الکترون های s و p جفت نشده هستند. شکل خطی نیز مشخصه مولکول های عناصر دیگر است (0=C=0,HC≡CH) که در آن پیوندها توسط اتم های هیبرید شده sp تشکیل می شوند.
 طرح هیبریداسیون sp 2 اوربیتال های اتمی و شکل مثلثی مسطح مولکول که به دلیل هیبریداسیون sp 2 اوربیتال های اتمی است.
طرح هیبریداسیون sp 2 اوربیتال های اتمی و شکل مثلثی مسطح مولکول که به دلیل هیبریداسیون sp 2 اوربیتال های اتمی است. این نوع هیبریداسیون برای مولکول های عناصر p از گروه سوم معمول است، که اتم های آنها در حالت برانگیخته دارای ساختار الکترونیکی خارجی ns 1 np 2 هستند، که در آن n تعداد دوره ای است که عنصر در آن قرار دارد. بنابراین، در مولکول های VF 3، BCl 3، AlF 3 و در سایر مولکول ها به دلیل اوربیتال های هیبرید شده ی sp 2 اتم مرکزی، پیوندهایی تشکیل می شود.
 طرح هیبریداسیون sp 3 اوربیتال های اتمی
طرح هیبریداسیون sp 3 اوربیتال های اتمی قرار دادن اوربیتال های هیبرید شده اتم مرکزی در زاویه 109 0 28` باعث شکل چهار وجهی مولکول ها می شود. این برای ترکیبات اشباع کربن چهار ظرفیتی CH 4 , CCl 4 , C 2 H 6 و سایر آلکان ها بسیار معمول است. نمونه هایی از ترکیبات عناصر دیگر با ساختار چهار وجهی به دلیل هیبریداسیون sp 3 اوربیتال های ظرفیت اتم مرکزی یون ها هستند: BH 4 - , BF 4 - , PO 4 3- , SO 4 2- , FeCl 4 - .
 طرح کلی هیبریداسیون sp 3d
طرح کلی هیبریداسیون sp 3d این نوع هیبریداسیون بیشتر در هالیدهای غیر فلزی یافت می شود. به عنوان مثال ساختار کلرید فسفر PCl 5 است که در طی تشکیل آن اتم فسفر (P ... 3s 2 3p 3) ابتدا به حالت برانگیخته می رود (P ... 3s 1 3p 3 3d 1) و سپس تحت هیبریداسیون s 1 p 3 d - پنج اوربیتال تک الکترونی معادل می شوند و با انتهای کشیده خود به گوشه های دو هرم مثلثی ذهنی جهت می یابند. این شکل مولکول PCl 5 را تعیین می کند، که وقتی پنج اوربیتال هیبرید شده s 1 p 3 d با اوربیتال های 3p از پنج اتم کلر همپوشانی دارند، تشکیل می شود.
- sp - هیبریداسیون. هنگامی که یک s-i با یک اوربیتال p ترکیب می شود، دو اوربیتال هیبرید شده sp به وجود می آیند که به طور متقارن در زاویه 180 0 قرار دارند.
- sp 2 - هیبریداسیون. ترکیب یک اوربیتال s و دو p منجر به تشکیل پیوندهای هیبرید شده sp 2 می شود که در زاویه 120 0 قرار دارند، بنابراین مولکول شکل یک مثلث منظم را به خود می گیرد.
- sp 3 - هیبریداسیون. ترکیب چهار اوربیتال - یک s- و سه p منجر به هیبریداسیون sp 3 می شود که در آن چهار اوربیتال هیبرید شده به طور متقارن در فضا به چهار راس چهار وجهی جهت گیری می شوند ، یعنی در زاویه 109 0 28 `.
- sp 3 d - هیبریداسیون. ترکیب یک اوربیتال s، سه p و یک d هیبریداسیون sp 3 d می دهد که جهت گیری فضایی پنج اوربیتال هیبرید شده sp 3 d را به راس های دو هرم مثلثی تعیین می کند.
- انواع دیگر هیبریداسیون در مورد هیبریداسیون sp 3 d 2، شش اوربیتال هیبرید شده sp 3 d 2 به سمت راس های هشت وجهی هدایت می شوند. جهت گیری هفت اوربیتال به رئوس دو هرم پنج ضلعی مربوط به هیبریداسیون sp 3 d 3 (یا گاهی sp 3 d 2 f) اوربیتال های ظرفیت اتم مرکزی مولکول یا مجتمع است.
روش هیبریداسیون اوربیتال های اتمی ساختار هندسی تعداد زیادی مولکول را توضیح می دهد، با این حال، طبق داده های تجربی، مولکول هایی با زوایای پیوند کمی متفاوت بیشتر مشاهده می شوند. به عنوان مثال، در مولکول های CH 4، NH 3 و H 2 O، اتم های مرکزی در حالت هیبرید شده sp 3 هستند، بنابراین می توان انتظار داشت که زوایای پیوند در آنها برابر با زوایای چهار وجهی (~ 109.5 0) باشد. به طور تجربی ثابت شده است که زاویه پیوند در مولکول CH 4 در واقع 109.5 0 است. با این حال، در مولکول های NH 3 و H 2 O، مقدار زاویه پیوند از زاویه چهار وجهی منحرف می شود: در مولکول NH 3 107.3 و در مولکول H 2 O 104.5 0 است. چنین انحراف هایی با حضور توضیح داده می شود. یک جفت الکترون تقسیم نشده در اتم های نیتروژن و اکسیژن. یک اوربیتال دو الکترونی که شامل یک جفت الکترون مشترک نیست، به دلیل افزایش چگالی، اوربیتالهای ظرفیتی یک الکترونی را دفع میکند که منجر به کاهش زاویه پیوند میشود. در اتم نیتروژن در مولکول NH 3، از چهار اوربیتال هیبرید شده sp 3، سه اوربیتال تک الکترونی با سه اتم H پیوند ایجاد میکنند و اوربیتال چهارم حاوی یک جفت الکترون مشترک است.
یک جفت الکترون بیپیوند، که یکی از اوربیتالهای هیبرید شده sp 3 را به سمت راس چهار وجهی اشغال میکند، اوربیتالهای تکالکترونی را دفع میکند، باعث توزیع نامتقارن چگالی الکترونی اطراف اتم نیتروژن میشود و در نتیجه پیوند را فشرده میکند. زاویه 107.3 0 . تصویر مشابهی از کاهش زاویه پیوند از 109.5 0 به 107 0 در نتیجه عمل جفت الکترون مشترک اتم N نیز در مولکول NCl 3 مشاهده می شود.
 انحراف زاویه پیوند از چهار وجهی (109.5 0) در مولکول: الف) NH3. ب) NCl3
انحراف زاویه پیوند از چهار وجهی (109.5 0) در مولکول: الف) NH3. ب) NCl3 در اتم اکسیژن در مولکول H 2 O، چهار اوربیتال هیبرید شده sp 3 دارای دو اوربیتال یک الکترونی و دو اوربیتال دو الکترونی هستند. اوربیتال های هیبرید شده یک الکترون در تشکیل دو پیوند با دو اتم H شرکت می کنند و دو جفت دو الکترونی تقسیم نشده باقی می مانند، یعنی فقط به اتم H تعلق دارند. این عدم تقارن توزیع چگالی الکترون را در اطراف اتم O افزایش می دهد و زاویه پیوند را نسبت به چهار وجهی به 104.5 0 کاهش می دهد.
در نتیجه، تعداد جفتهای الکترون غیرپیوندی اتم مرکزی و قرارگیری آنها در اوربیتالهای هیبرید شده بر پیکربندی هندسی مولکولها تأثیر میگذارد.
ویژگی های پیوند کووالانسی
یک پیوند کووالانسی دارای مجموعه ای از ویژگی های خاص است که آن را مشخص می کند. ویژگی های خاص، یا خصوصیات اینها، علاوه بر ویژگی هایی که قبلاً «انرژی پیوند» و «طول پیوند» در نظر گرفته شده اند، عبارتند از: زاویه پیوند، اشباع، جهت، قطبیت و موارد مشابه.
1. زاویه ظرفیت- این زاویه بین محورهای پیوند مجاور است (یعنی خطوط مشروط که از طریق هسته اتم های شیمیایی متصل در یک مولکول کشیده می شوند). مقدار زاویه پیوند به ماهیت اوربیتال ها، نوع هیبریداسیون اتم مرکزی، تأثیر جفت های الکترونی مشترک که در تشکیل پیوندها شرکت نمی کنند بستگی دارد.
2. اشباع. اتم ها توانایی تشکیل پیوندهای کووالانسی را دارند که اولاً با توجه به مکانیسم مبادله به دلیل الکترون های جفت نشده یک اتم تحریک نشده و به دلیل آن دسته از الکترون های جفت نشده ای که در نتیجه برانگیختگی آن به وجود می آیند می توانند تشکیل شوند و ثانیاً با توجه به مکانیسم دهنده-پذیرنده با این حال، تعداد کل پیوندهایی که یک اتم می تواند تشکیل دهد محدود است.
اشباع توانایی یک اتم یک عنصر برای تشکیل تعداد معین و محدودی پیوند کووالانسی با اتم های دیگر است.
بنابراین، دوره دوم که دارای چهار اوربیتال در سطح انرژی خارجی است (یک s- و سه p-)، پیوندهایی را تشکیل می دهند که تعداد آنها از چهار تجاوز نمی کند. اتم های عناصر دوره های دیگر با تعداد زیادیاوربیتال ها در سطح بیرونی می توانند پیوندهای بیشتری تشکیل دهند.
3. جهت گیری. بر اساس روش، پیوند شیمیایی بین اتم ها به دلیل همپوشانی اوربیتال هایی است که به استثنای اوربیتال های s، جهت گیری خاصی در فضا دارند که منجر به جهت پیوند کووالانسی می شود.
جهت یک پیوند کووالانسی چنین ترتیبی از چگالی الکترون بین اتم ها است که با جهت گیری فضایی اوربیتال های ظرفیت تعیین می شود و حداکثر همپوشانی آنها را تضمین می کند.
زیرا اوربیتال های الکترونی دارند اشکال گوناگونو جهت گیری متفاوت در فضا، آنگاه می توان همپوشانی متقابل آنها را تحقق بخشید راه های مختلف. بسته به این، پیوندهای σ-، π- و δ متمایز می شوند.
پیوند سیگما (پیوند σ) همپوشانی اوربیتال های الکترونی است که در آن حداکثر چگالی الکترون در امتداد یک خط فرضی که دو هسته را به هم متصل می کند متمرکز می شود.
پیوند سیگما می تواند توسط دو الکترون s، یک الکترون s و یک p، دو الکترون p یا دو الکترون d تشکیل شود. چنین پیوند σ با وجود یک منطقه از اوربیتال های الکترونی همپوشانی مشخص می شود، همیشه منفرد است، یعنی تنها توسط یک جفت الکترون تشکیل می شود.

انواع مختلفی از جهت گیری فضایی اوربیتال های "خالص" و اوربیتال های هیبرید شده همیشه امکان همپوشانی اوربیتال ها را در محور پیوند فراهم نمی کند. همپوشانی اوربیتال های ظرفیت می تواند در هر دو طرف محور پیوند رخ دهد - به اصطلاح همپوشانی "جانبی" که اغلب در طول تشکیل پیوندهای π رخ می دهد.
پیوند پی (پیوند π) همپوشانی اوربیتال های الکترونی است که در آن حداکثر چگالی الکترون در دو طرف خطی که هسته اتم ها را به هم متصل می کند (یعنی از محور پیوند) متمرکز می شود.
پیوند pi می تواند از برهم کنش دو اوربیتال موازی p، دو اوربیتال d یا سایر ترکیباتی از اوربیتال ها که محورهای آنها با محور پیوند منطبق نیست تشکیل شود.
 طرح هایی برای تشکیل پیوند π بین اتم های شرطی A و B در همپوشانی جانبی اوربیتال های الکترونی
طرح هایی برای تشکیل پیوند π بین اتم های شرطی A و B در همپوشانی جانبی اوربیتال های الکترونی 4. تعدد.این مشخصه با تعداد جفت الکترون های مشترکی که اتم ها را به هم متصل می کنند تعیین می شود. یک پیوند کووالانسی در تعدد می تواند منفرد (ساده)، دوتایی و سه گانه باشد. پیوند بین دو اتم با استفاده از یک جفت الکترون مشترک، یک پیوند واحد (ساده)، دو جفت الکترون - یک پیوند دوگانه، سه جفت الکترون - یک پیوند سه گانه نامیده می شود. بنابراین، در مولکول هیدروژن H 2، اتم ها با یک پیوند منفرد (H-H)، در مولکول اکسیژن O 2 - دو برابر (B \u003d O)، در مولکول نیتروژن N 2 - سه گانه (N≡N) متصل می شوند. تعدد پیوندها در ترکیبات آلی - هیدروکربن ها و مشتقات آنها از اهمیت ویژه ای برخوردار است: در اتان C 2 H 6 یک پیوند منفرد (C-C) بین اتم های C رخ می دهد ، در اتیلن C 2 H 4 - دو برابر (C \u003d C) در استیلن C 2 H 2 - سه گانه (C ≡ C) (C≡C).
تعدد پیوند بر انرژی تأثیر می گذارد: با افزایش تعدد، استحکام آن افزایش می یابد. افزایش در تعدد منجر به کاهش فاصله بین هسته ای (طول پیوند) و افزایش انرژی اتصال می شود.
 تعدد پیوند بین اتمهای کربن: الف) پیوند σ در اتان H3C-CH3. ب) دو σ + π-پیوند در اتیلن H2C = CH2. ج) پیوند سه گانه σ+π+π در استیلن HC≡CH
تعدد پیوند بین اتمهای کربن: الف) پیوند σ در اتان H3C-CH3. ب) دو σ + π-پیوند در اتیلن H2C = CH2. ج) پیوند سه گانه σ+π+π در استیلن HC≡CH 5. قطبیت و قطبی پذیری. چگالی الکترونی یک پیوند کووالانسی می تواند در فضای بین هسته ای متفاوت باشد.
قطبیت یک ویژگی پیوند کووالانسی است که با محل چگالی الکترون در فضای بین هسته ای نسبت به اتم های متصل تعیین می شود.
بسته به محل چگالی الکترون در فضای بین هسته ای، پیوندهای کووالانسی قطبی و غیر قطبی متمایز می شوند. پیوند غیرقطبی پیوندی است که در آن ابر الکترونی مشترک به طور متقارن نسبت به هسته اتم های متصل قرار گرفته و به طور مساوی به هر دو اتم تعلق دارد.
مولکول های دارای این نوع پیوند را غیر قطبی یا هم هسته ای می نامند (یعنی آنهایی که شامل اتم های یک عنصر هستند). پیوند غیر قطبیخود را به عنوان یک قاعده در مولکول های هم هسته (Н 2، Cl 2، N 2، و غیره) یا، به ندرت، در ترکیباتی که توسط اتم های عناصر با مقادیر الکترونگاتیوی مشابه، به عنوان مثال، کربن SiC تشکیل می شود، نشان می دهد. پیوند قطبی (یا هتروپولار) پیوندی است که در آن ابر الکترونی مشترک نامتقارن است و به یکی از اتم ها منتقل می شود.
مولکول های دارای پیوند قطبی قطبی یا هترونهسته ای نامیده می شوند. در مولکولهای دارای پیوند قطبی، جفت الکترون تعمیمیافته به سمت اتم با الکترونگاتیوی بالاتر جابهجا میشود. در نتیجه یک بار منفی جزئی خاص (δ-) که مؤثر نامیده می شود، روی این اتم ظاهر می شود و اتمی با الکترونگاتیوی پایین تر دارای بار مثبت جزئی به همان اندازه، اما مخالف علامت (δ+) است. به عنوان مثال، به طور تجربی ثابت شده است که بار موثر اتم هیدروژن در مولکول هیدروژن کلرید HCl δH=+0.17 و بر اتم کلر δCl=-0.17 بار الکترون مطلق است.
برای تعیین اینکه چگالی الکترونی پیوند کووالانسی قطبی در کدام جهت جابجا می شود، لازم است الکترون های هر دو اتم را با هم مقایسه کنیم. به منظور افزایش الکترونگاتیوی، رایج ترین عناصر شیمیایی به ترتیب زیر قرار می گیرند:
مولکول های قطبی نامیده می شوند دوقطبی ها - سیستم هایی که در آنها مراکز ثقل بارهای مثبت هسته و بارهای منفی الکترون ها بر هم منطبق نیستند.
دوقطبی سیستمی است که مجموعهای از بارهای الکتریکی دو نقطهای است که از نظر قدر مساوی و از نظر علامت مخالف هستند که در فاصلهای از یکدیگر قرار دارند.
فاصله بین مراکز جذب طول دوقطبی نامیده می شود و با حرف l نشان داده می شود. قطبیت یک مولکول (یا پیوند) از نظر کمی با گشتاور دوقطبی μ مشخص می شود که در مورد یک مولکول دو اتمی برابر است با حاصل ضرب طول دوقطبی و مقدار بار الکترون: μ=el.
در واحدهای SI، گشتاور دوقطبی با [C×m] (متر کولن) اندازهگیری میشود، اما اغلب از واحد خارج از سیستم [D] استفاده میکنند (debye): 1D = 3.33 10 -30 C×m. مقدار گشتاورهای دوقطبی مولکول های کووالانسی در 0-4 D و یونی - 4-11D متفاوت است. هر چه طول دوقطبی بیشتر باشد، مولکول قطبی تر است.
یک ابر الکترونی مشترک در یک مولکول می تواند توسط یک میدان الکتریکی خارجی، از جمله میدان یک مولکول یا یون دیگر، جابجا شود.
قطبش پذیری تغییر در قطبیت یک پیوند در نتیجه جابجایی الکترون های تشکیل دهنده پیوند تحت تأثیر میدان الکتریکی خارجی، از جمله میدان نیروی ذره دیگر است.
قطبش پذیری یک مولکول به تحرک الکترون ها بستگی دارد، که هر چه قوی تر باشد، فاصله از هسته بیشتر است. علاوه بر این، قطبش پذیری به جهت میدان الکتریکی و توانایی ابرهای الکترونی برای تغییر شکل بستگی دارد. در اثر یک میدان خارجی، مولکول های غیر قطبی قطبی می شوند و مولکول های قطبی حتی قطبی تر می شوند، یعنی یک دوقطبی در مولکول ها القا می شود که به آن دو قطبی کاهش یافته یا القایی می گویند.
 طرح تشکیل یک دوقطبی القایی (کاهش یافته) از یک مولکول غیر قطبی تحت تأثیر میدان نیروی یک ذره قطبی - یک دوقطبی
طرح تشکیل یک دوقطبی القایی (کاهش یافته) از یک مولکول غیر قطبی تحت تأثیر میدان نیروی یک ذره قطبی - یک دوقطبی برخلاف دوقطبی های دائمی، دوقطبی های القایی تنها تحت تأثیر میدان الکتریکی خارجی به وجود می آیند. پلاریزاسیون نه تنها می تواند باعث قطبی شدن پیوند شود، بلکه باعث گسیختگی آن نیز می شود که در آن انتقال جفت الکترون اتصال به یکی از اتم ها رخ می دهد و یون های دارای بار منفی و مثبت تشکیل می شوند.
قطبیت و قطبش پذیری پیوندهای کووالانسی، واکنش پذیری مولکول ها را نسبت به معرف های قطبی تعیین می کند.
خواص ترکیبات با پیوند کووالانسی
مواد با پیوند کووالانسی به دو گروه نابرابر تقسیم می شوند: مولکولی و اتمی (یا غیر مولکولی) که بسیار کوچکتر از مواد مولکولی هستند.
ترکیبات مولکولی در شرایط عادی می توانند متفاوت باشند حالت های تجمع: به شکل گازها (CO 2، NH 3، CH 4، Cl 2، O 2، NH 3)، مایعات فرار (Br 2، H 2 O، C 2 H 5 OH) یا مواد کریستالی جامد که اکثر آنها حتی در حرارت بسیار خفیف می تواند به سرعت ذوب شود و به راحتی تصعید شود (S 8، P 4، I 2، شکر C 12 H 22 O 11، "یخ خشک" CO 2).
نقطه ذوب پایین، تصعید و جوش مواد مولکولی با نیروهای بسیار ضعیف برهمکنش بین مولکولی در کریستال ها توضیح داده می شود. به همین دلیل است که کریستال های مولکولی با استحکام، سختی و رسانایی الکتریکی بالا (یخ یا شکر) مشخص نمی شوند. علاوه بر این، مواد با مولکول های قطبی دارای نقطه ذوب و جوش بالاتری نسبت به مواد با مولکول های غیر قطبی هستند. برخی از آنها در حلال های قطبی یا سایر حلال ها محلول هستند. برعکس، مواد با مولکول های غیر قطبی در حلال های غیر قطبی (بنزن، تتراکلرید کربن) بهتر حل می شوند. بنابراین، ید که مولکول های آن غیر قطبی هستند، در آب قطبی حل نمی شود، بلکه در CCl 4 غیر قطبی و الکل با قطبیت پایین حل می شود.
مواد غیر مولکولی (اتمی) با پیوندهای کووالانسی (الماس، گرافیت، سیلیکون Si، کوارتز SiO 2، کربن SiC و غیره) کریستال های بسیار قوی را تشکیل می دهند، به استثنای گرافیت که ساختار لایه ای دارد. به عنوان مثال، شبکه کریستالی الماس یک چارچوب سه بعدی منظم است که در آن هر اتم کربن هیبرید شده sp 3 توسط پیوند σ به چهار اتم C همسایه متصل می شود. در واقع، کل کریستال الماس یک مولکول عظیم و بسیار قوی است. بلورهای سیلیکونی Si که به طور گسترده در الکترونیک رادیویی و مهندسی الکترونیک استفاده می شود، ساختار مشابهی دارند. اگر نیمی از اتمهای C در الماس را با اتمهای Si جایگزین کنیم، بدون اینکه ساختار قاب بلور را مختل کنیم، کریستالی از کربوراندوم - کاربید سیلیکون SiC - یک ماده بسیار سخت بهعنوان ماده ساینده به دست میآییم. و اگر در شبکه کریستالیسیلیکون بین هر دو اتم Si یک اتم O را وارد می کند، سپس ساختار کریستالی کوارتز SiO 2 تشکیل می شود - همچنین یک ماده بسیار جامد، که انواع مختلفی از آن نیز به عنوان یک ماده ساینده استفاده می شود.
بلورهای الماس، سیلیکون، کوارتز و ساختار مشابه، کریستال های اتمی هستند، آنها "ابر مولکول های" عظیمی هستند، بنابراین فرمول های ساختاری آنها را نمی توان به طور کامل نشان داد، بلکه فقط به عنوان یک قطعه جداگانه، به عنوان مثال:
 کریستال های الماس، سیلیکون، کوارتز
کریستال های الماس، سیلیکون، کوارتز کریستال های غیر مولکولی (اتمی)، متشکل از اتم های یک یا دو عنصر که با پیوندهای شیمیایی به هم متصل شده اند، متعلق به مواد نسوز هستند. دمای ذوب بالا به دلیل نیاز به صرف مقدار زیادی انرژی برای شکستن پیوندهای شیمیایی قوی در طول ذوب بلورهای اتمی است و نه برهمکنش بین مولکولی ضعیف، مانند مواد مولکولی. به همین دلیل، بسیاری از کریستال های اتمی هنگام گرم شدن ذوب نمی شوند، بلکه تجزیه می شوند یا بلافاصله به حالت بخار (تععید) می روند، به عنوان مثال، گرافیت در دمای 3700 درجه سانتی گراد تصعید می شود.
مواد غیر مولکولی با پیوند کووالانسی در آب و سایر حلال ها نامحلول هستند و اکثر آنها رسانا نیستند. برق(به جز گرافیت، که ذاتی هدایت الکتریکی است، و نیمه هادی ها - سیلیکون، ژرمانیوم و غیره).
پیوند کووالانسی پیوند اتم ها با کمک جفت الکترون های مشترک (مشترک بین آنها) است.در کلمه "کووالانسی" پیشوند "co-" به معنای مشارکت مشترک است. و "والنتا" در ترجمه به روسی - قدرت، توانایی. در این مورد منظور ما توانایی اتم ها برای پیوند با اتم های دیگر است.
هنگامی که یک پیوند کووالانسی تشکیل می شود، اتم ها الکترون های خود را به عنوان یک "قلک" مشترک - یک اوربیتال مولکولی، که از پوسته های اتمی اتم های منفرد تشکیل می شود، متحد می کنند. این پوسته جدید تا حد امکان حاوی الکترون های کامل است و اتم ها را با لایه های اتمی ناقص خود جایگزین می کند.
ایده های مربوط به مکانیسم تشکیل مولکول هیدروژن به مولکول های پیچیده تر گسترش یافت. نظریه پیوند شیمیایی که بر این اساس توسعه یافت نامیده شد روش باند ظرفیتی (روش VS). روش VS بر اساس مقررات زیر است:
1) یک پیوند کووالانسی توسط دو الکترون با اسپین های مخالف ایجاد می شود و این جفت الکترون متعلق به دو اتم است.
2) هر چه پیوند کووالانسی قوی تر باشد، ابرهای الکترونی بیشتر همپوشانی دارند.
ترکیبی از پیوندهای دو مرکزی دو الکترونی که ساختار الکترونیکی مولکول را منعکس می کنند، طرح های ظرفیت نامیده می شوند. نمونه هایی از طرح های ظرفیت ساختمان:
در طرحهای ظرفیت، بازنماییها به وضوح تجسم مییابند لوئیسدر مورد تشکیل یک پیوند شیمیایی از طریق اجتماعی شدن الکترون ها با تشکیل یک پوسته الکترونی گاز نجیب: هیدروژن- از دو الکترون (پوسته او)، برای نیتروژن- از هشت الکترون (پوسته Ne).
29. پیوند کووالانسی غیرقطبی و قطبی.
اگر یک مولکول دو اتمی از اتم های یک عنصر تشکیل شده باشد، ابر الکترونی به طور متقارن با توجه به هسته اتم ها در فضا توزیع می شود. چنین پیوند کووالانسی غیرقطبی نامیده می شود. اگر یک پیوند کووالانسی بین اتم های عناصر مختلف تشکیل شود، ابر الکترونی مشترک به سمت یکی از اتم ها منتقل می شود. در این حالت پیوند کووالانسی قطبی است.
در نتیجه تشکیل یک پیوند کووالانسی قطبی، یک اتم الکترونگاتیو بیشتر بار منفی جزئی و اتمی با الکترونگاتیوی پایین تر بار مثبت جزئی به دست می آورد. این بارها معمولاً به عنوان بارهای مؤثر اتم های موجود در مولکول نامیده می شوند. ممکن است کسری باشند.
30. روشهای بیان پیوند کووالانسی.
دو راه اصلی برای ایجاد وجود دارد پیوند کووالانسی * .
1) یک جفت الکترون تشکیل دهنده یک پیوند می تواند به دلیل جفت نشدن تشکیل شود الکترون هاموجود در حالت غیر هیجانانگیز اتم ها. افزایش تعداد پیوندهای کووالانسی ایجاد شده با آزاد شدن انرژی بیشتر از انرژی صرف شده برای تحریک اتم همراه است. از آنجایی که ظرفیت یک اتم به تعداد الکترون های جفت نشده بستگی دارد، تحریک منجر به افزایش ظرفیت می شود. در اتم های نیتروژن، اکسیژن، فلوئور، تعداد الکترون های جفت نشده افزایش نمی یابد، زیرا در سطح دوم هیچ رایگان وجود ندارد اوربیتال ها*، و حرکت الکترون ها به سطح سوم کوانتومی به انرژی بسیار بیشتری نسبت به انرژی که در طول تشکیل پیوندهای اضافی آزاد می شود نیاز دارد. بدین ترتیب، هنگامی که یک اتم برانگیخته می شود، انتقال الکترون ها به آزاد می شوداوربیتال ها فقط در همان سطح انرژی ممکن است.
2) پیوندهای کووالانسی می توانند به دلیل الکترون های جفتی موجود در لایه الکترونی بیرونی اتم تشکیل شوند. در این حالت، اتم دوم باید یک اوربیتال آزاد در لایه بیرونی داشته باشد. اتمی که جفت الکترون خود را برای تشکیل پیوند کووالانسی * فراهم می کند، دهنده نامیده می شود و اتمی که یک اوربیتال خالی ایجاد می کند، گیرنده نامیده می شود. پیوند کووالانسی که به این ترتیب ایجاد می شود پیوند دهنده - گیرنده نامیده می شود. در کاتیون آمونیوم، این پیوند از نظر خواص کاملاً مشابه با سه پیوند کووالانسی دیگر است. اول تحصیل کردهبنابراین، اصطلاح "بخشنده-پذیرنده" به معنای خاصی نیست نوع اتصال، اما تنها راهی برای شکل گیری آن است.
پیوند کووالانسی(از لاتین "with" مشترک و "vales" معتبر) توسط یک جفت الکترون متعلق به هر دو اتم انجام می شود. بین اتم های غیر فلزات تشکیل شده است.
الکترونگاتیوی غیر فلزات بسیار زیاد است، به طوری که در طول برهمکنش شیمیایی دو اتم غیر فلز، انتقال کامل الکترون ها از یکی به دیگری (مانند مورد) غیرممکن است. در این مورد، ادغام الکترون برای انجام ضروری است.
به عنوان مثال، اجازه دهید تعامل اتم های هیدروژن و کلر را مورد بحث قرار دهیم:
H 1s 1 - یک الکترون
Cl 1s 2 2s 2 2 p6 3 s2 3 p5 - هفت الکترون در سطح بیرونی
هر یک از دو اتم فاقد یک الکترون هستند تا یک لایه الکترونی کامل بیرونی داشته باشند. و هر یک از اتم ها "برای استفاده مشترک" یک الکترون را اختصاص می دهد. بنابراین، قانون octet برآورده می شود. بهترین راه برای نشان دادن این با فرمول های لوئیس است:
تشکیل پیوند کووالانسی
الکترون های مشترک اکنون به هر دو اتم تعلق دارند. اتم هیدروژن دارای دو الکترون (الکترون خودش و الکترون مشترک اتم کلر) و اتم کلر دارای هشت الکترون است (الکترون خودش به علاوه الکترون مشترک اتم هیدروژن). این دو الکترون مشترک یک پیوند کووالانسی بین اتم های هیدروژن و کلر تشکیل می دهند. ذره ای که با پیوند دو اتمی تشکیل می شود نامیده می شود مولکول
پیوند کووالانسی غیر قطبی
یک پیوند کووالانسی می تواند بین دو تشکیل شود هماناتم ها مثلا:

این نمودار توضیح می دهد که چرا هیدروژن و کلر به عنوان مولکول های دو اتمی وجود دارند. به لطف جفت شدن و اجتماعی شدن دو الکترون، می توان قانون اکتت را برای هر دو اتم برآورده کرد.
علاوه بر پیوندهای منفرد، یک پیوند کووالانسی دو یا سه گانه می تواند تشکیل شود، به عنوان مثال، در مولکول های اکسیژن O 2 یا نیتروژن N 2. اتم های نیتروژن هر کدام دارای پنج الکترون ظرفیت هستند، بنابراین برای تکمیل پوسته به سه الکترون دیگر نیاز است. این با به اشتراک گذاشتن سه جفت الکترون به دست می آید، همانطور که در زیر نشان داده شده است:

ترکیبات کووالانسی - معمولاً گازها، مایعات یا نقطه ذوب نسبتاً پایین مواد جامد. یکی از استثناهای نادر الماس است که در دمای بالای 3500 درجه سانتیگراد ذوب می شود. این به دلیل ساختار الماس است که یک شبکه پیوسته از اتمهای کربن با پیوند کووالانسی است و نه مجموعهای از مولکولهای منفرد. در واقع، هر کریستال الماس، صرف نظر از اندازه آن، یک مولکول عظیم است.
پیوند کووالانسی زمانی رخ می دهد که الکترون های دو اتم غیرفلز به یکدیگر بپیوندند. ساختار حاصل را مولکول می نامند.
پیوند کووالانسی قطبی
در بیشتر موارد، دو اتم پیوند کووالانسی دارند ناهمسانالکترونگاتیوی و الکترون های مشترک به طور مساوی به دو اتم تعلق ندارند. بیشتر اوقات آنها به یک اتم نزدیکتر از اتم دیگر هستند. برای مثال، در یک مولکول هیدروژن کلرید، الکترونهایی که پیوند کووالانسی تشکیل میدهند به اتم کلر نزدیکتر هستند، زیرا الکترونگاتیوی آن بالاتر از هیدروژن است. با این حال، تفاوت در توانایی جذب الکترون آنقدر زیاد نیست که انتقال کامل یک الکترون از اتم هیدروژن به اتم کلر وجود داشته باشد. بنابراین، پیوند بین اتم های هیدروژن و کلر را می توان به عنوان تلاقی بین یک پیوند یونی (انتقال الکترون کامل) و یک پیوند کووالانسی غیرقطبی (آرایش متقارن یک جفت الکترون بین دو اتم) مشاهده کرد. بار جزئی اتم ها نشان داده می شود نامه یونانیδ. چنین ارتباطی نامیده می شود کووالانسی قطبی پیوند می دهند و به مولکول هیدروژن کلرید گفته می شود که قطبی است، یعنی دارای یک انتهای بار مثبت (اتم هیدروژن) و یک انتهای بار منفی (اتم کلر) است.

جدول زیر انواع اصلی پیوندها و نمونه هایی از مواد را فهرست می کند:

مکانیسم تبادل و گیرنده دهنده تشکیل پیوند کووالانسی

1) مکانیسم تبادل. هر اتم یک الکترون جفت نشده به یک جفت الکترون مشترک کمک می کند.
2) مکانیسم دهنده - پذیرنده. یک اتم (دهنده) یک جفت الکترون و اتم دیگر (پذیرنده) یک اوربیتال خالی برای این جفت فراهم می کند.