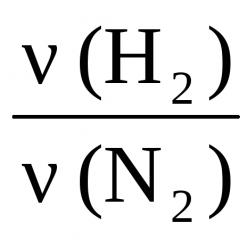Расчеты массы вещества по уравнению химической реакции. Расчеты по химическим уравнением Как вычислить химическую реакцию
С помощью стехиометрических коэффициентов схема химической реакции переходит в ее уравнение, которое в явном виде отражает закон сохранения количества атомов каждого вида при переходе от исходных веществ (реагентов) к продуктам реакции.
Стехиометрические коэффициенты позволяют установить связь между количествами участвующих в реакции веществ на основе следующего правила:
коэффициенты в химическом уравнении задают молярные пропорции (отношения), в которых вступают в реакцию исходные вещества (реагенты) и образуются продукты реакции.
Рассмотрим в качестве примера реакцию синтеза аммиака:
3H 2 + N 2 = 2NH 3 ,
для которой согласно приведенному правилу можно записать
где индексы «пр.» и «обр.» соответствуют количествам прореагировавших и образовавшихся веществ. Последнее соотношение можно представить в ином виде:
а) для веществ H 2 и N 2:
или в другой форме
 ;
;
б) для веществ H 2 и NH 3: или
или ;
;
в) для веществ N 2 и NH 3: или
или .
.
Легко видеть, что все пропорции можно объединить и записать в виде:
 =
= .
.
Последнее равенство является основным расчетным уравнением , связывающим количества прореагировавших веществ и образовавшихся продуктов реакции. При необходимости в это уравнение можно из условия задачи ввести массы и объемы участников реакции, используя обычные соотношения.
Например, для реакции
4FeS 2 (т) + 11О 2 = 2Fe 2 O 3 (т) + 8SO 2 (г)
основное расчетное уравнение имеет вид:
и если в него ввести обычно задаваемые в задачах для твердых веществ их массы, а для газов – объемы, то оно примет следующую форму:
Методика вычислений с использованием основного расчетного уравнения химической реакции включает в себя несколько общих моментов:
1) Прежде всего определяют опорное вещество, по количеству которого проводят весь последующий расчет. В условии задачи для него задана или масса, или объем, или концентрация, которые, в свою очередь, позволяют вычислить число молей опорного вещества. Как правило, это не составляет большого труда, а исключение относится к так называемым задачам на избыток и недостаток, когдаопорное вещество нужно выбрать издвух исходных. Дело в том, что при приготовлении реакционной смеси исходные вещества можно смешивать в любых пропорциях, но реагировать друг с другом они будут всегда в строго определенных пропорциях, которые устанавливают для них стехиометрические коэффициенты в уравнении химической реакции. В этих условиях вполне возможна ситуация, когда одно из исходных веществ прореагирует полностью, а часть другого останется не прореагировавшей и тогда говорят, что первое вещество взято в недостатке по отношению ко второму и, наоборот, второе вещество находится в избытке по отношению к первому. В данном случае в качестве опорного вещества следует выбрать исходное вещество, взятое в недостатке, поскольку именно его количество будет определять как окончание реакции, так и количества образующихся продуктов.
Как определить опорное вещество, если в задаче указаны данные (массы, объемы и др.) для обоих исходных веществ? Пусть в реакцию вступают два вещества А и В
аА + вВ → продукты реакции,
а исходные количества этих веществ 0 (А) и 0 (В) можно вычислить из условия задачи.
Для
ответа на поставленный вопрос нужно
сравнить два числа
 ,
где возможны три варианта:
,
где возможны три варианта:
I
вар.
 ,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
II
вар.
 ,
тогда вещество А взято в избытке и
опорным будет вещество В;
,
тогда вещество А взято в избытке и
опорным будет вещество В;
III
вар.
 ,
тогда вещество В будет в избытке и
опорным является вещество А.
,
тогда вещество В будет в избытке и
опорным является вещество А.
Окончание необратимых химических реакций в первом варианте происходит в момент одновременного исчезновения обоих исходных веществ, а в двух других – в момент исчезновения вещества, взятого в недостатке, причем в конечной смеси веществ, наряду с продуктами реакции, будет присутствовать не прореагировавший остаток вещества, взятого в избытке.
2) Из основного расчетного уравнения вытекает простое правило определения числа молей вступивших в реакцию исходных веществ и образовавшихся продуктов по числу молей опорного вещества:
для определения числа молей прореагировавшего или образовавшегося в реакции вещества необходимо число молей опорного вещества разделить на его стехиометрический коэффициент и этот результат умножить на стехиометрический коэффициент определяемого вещества.
Для реакции 2Al + 6HCl = 2AlCl 3 + H 2 ,
где опорным веществом, например, является алюминий можно записать:



Определив количества интересующих нас веществ, легко рассчитать их массы, объемы и концентрации, то есть те характеристики участников химической реакции, которые фигурируют в условии задачи.
Таким образом, общая схема расчета по уравнению химической реакции может быть представлена в виде:
Необратимая реакция.
Пусть
 и
и начальные количества реагентов А и В и
начальные количества реагентов А и В и ,
т.е. вещество А взято в избытке, тогда
,
т.е. вещество А взято в избытке, тогда
a A + в В = с С + d D
|
(избыток) |
(недостаток) | |||||
|
окончание реакции: |
|
|
|
|||
Обратимая реакция.
В этом случае реакция заканчивается установлением химического равновесия и равновесная смесь содержит как продукты реакции, так и остаток исходных веществ. Пусть к моменту установления равновесия образовалось, например, х моль продукта С – это опорное вещество, то
a A + в В с С + d D
|
Начало реакции: |
|
| ||
|
Равновесие: |
|
|
|
|
Пример 1. Раствор, содержащий 20,0 г гидроксида натрия поглотил 6,72 л углекислого газа (н. у.). Определите продукты реакции и их количества.
При поглощении раствором щелочи кислотных оксидов (СО 2 ,SO 2 ,P 2 O 5 и др.) или водородных соединений (H 2 Sи др.), которым соответствуют многоосновные кислоты, на первом этапе при избытке щелочи всегда образуются средние соли, которые на втором этапе при наличии избытка поглощаемого реагента частично или полностью переходят в кислые соли:
СО 2 (газ) + 2 NaOH = Na 2 CO 3 + Н 2 О
Остаток углекислого газа реагирует с карбонатом натрия:
Na 2 CO 3 + СО 2 (газ) + Н 2 О = 2 NaHСО 3
|
окончание реакции: |
|
|
Итак, в растворе присутствует смесь солей: 0,1 моль NaHCO 3 и 0,2 моль Na 2 CO 3 .
Пример 2. В стакан с 200 мл раствора фосфорной кислоты с молярной концентрацией 0,5 моль/л внесли 6 г гидроксида натрия. Определите состав раствора после окончания реакции.
При нейтрализации щелочью (NaOH, KOH, NH 3 и др.) многоосновных кислот происходит последовательное замещение атомов водорода на металл или аммонийную группу и состав продуктов реакции зависит от соотношения количеств реагентов. В нашем случае, если – образуетсяNaH 2 PO 4 ; если 1: 2 , то Na 2 HPO 4 и если 1: 3 , то Na 3 PO 4 . В промежуточных вариантах возникает смесь солей.
Найдем
исходные количества реагентов:
; ,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
NaH 2 PO 4 + NaOH = Na 2 HPO 4 + H 2 O
Итак, в растворе после реакции присутствует смесь солей – по 0,05 моль NaH 2 PO 4 и Na 2 HPO 4 .
Успех в проведении расчетов по цепочкам химических уравнений в случае, когда продукт одной реакции является исходным веществом для другой, зависит от правильного выбора последовательности переходов от одного уравнения к другому. Выбрав согласно условию задачи опорное вещество, стрелками удобно указать последовательность расчета, помня при этом, что вещество, полученное в предыдущей реакции, в том же количестве используется в последующей если, естественно, в ходе всего многостадийного процесса нет потерь и выход каждой реакции 100 %.
Пример 3. Сколько литров хлора и водорода (н.у.) необходимо для получения хлороводорода, способного нейтрализовать раствор щелочи, образующийся при растворении в воде 13,7 г бария.
Составим уравнения всех реакций и стрелками укажем последовательность расчета:

Опорное вещество барий и его количество
(Ва) =
 .
.
Цепочка расчетов:
уравнение (I) - (Ba(OH) 2 /
I) = =>
=>
уравнение (II) - (HCl / II)=> уравнение (III) –
(Cl 2) =(H 2) = ,
,
тогда V(H 2) = V(Cl 2) = 0,1 моль· 22,4 л/моль = 2,24 л.
При решении задач на смеси веществ необходимо прежде всего для каждого компонента смеси отдельно записать все химические реакции, в которых он может участвовать в соответствии с условием задачи. В качестве опорных веществ обычно выбирают вещества исходной смеси и их количества (число молей) обозначают как неизвестные – x, y, z, …., а затем составляют уравнения материального баланса по количеству, массе или объему (для газов) участников химических реакций, где два последних необходимо выразить через неизвестные. Число балансовых уравнений должно быть равно числу неизвестных. На последнем этапе решается полученная система алгебраических уравнений.
Пример 4. При сгорании 13,44 л (н. у.) смеси водорода, метана и угарного газа образовалось 8,96 л углекислого газа и 14,4 г воды. Определить количества газов в смеси.
Уравнения реакций:
2H 2 + O 2 = 2H 2 O (I)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Опорные вещества – CH 4 , H 2 и CO; обозначим их количества
ν(H 2) = x; ν(СH 4) = y; ν(CO) = z.
Составим три балансовых уравнения по числу неизвестных:
а) баланс по объему смеси:
V (H 2) + V(CH 4) + V(CO) = 13,44 л, введем в него неизвестные:
xV m + yV m + zV m = 13,44 или x + y + z = 0,6
моль;
0,6
моль;
б) баланс по количеству CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = ν общ. (CO 2), но
 ;
;
ν(CO 2 /
II) = ν(CH 4)
= y; ν(CO 2 /
III) =  z,
тогда
y + z = 0,4.
z,
тогда
y + z = 0,4.
в) баланс по количеству H 2 O:
ν(H 2 O/ I) + ν(H 2 O/ II) = ν общ. (H 2 O), но
 ,
,
 ;
; ,
,
тогда x + 2y = 0,8.
Итак, получаем систему уравнений вида
 ,
,
которая легко решается устно
x = 0,2 моль; y = 0,3 моль; z = 0,1 моль.
При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
Тема: Вещества и их превращения
Урок: Расчеты по уравнению химической реакции
Рассмотрим уравнение реакции образования воды из простых веществ:
2H 2 + O 2 = 2H 2 O
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода
.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и . Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной . Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. - М.: АСТ: Астрель, 2006. (с.40-48)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с. 73-75)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. - М.:Астрель, 2013. (§23)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§29)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. - М.: Просвещение, ОАО «Московские учебники», 2009. (с.45-47)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. - М.: Аванта+, 2003.
Дополнительные веб-ресурсы
2. Единая коллекция цифровых образовательных ресурсов ().
Домашнее задание
1) с. 73-75 №№ 2, 3, 5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2) с.135 №№ 3,4 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
Задание. Сколько литров кислорода (н. у.) вступит в реакцию при сгорании 4,8 г магния?
Периодический закон (ПЗ) и периодическая система (ПС)
элементов Д. И. Менделеева
Открытие ПЗ и построение ПС явились вершиной развития химии в 19 в (1869 г). Д.И. Менделеев расположил все известные в то время элементы (63) в порядке возрастания их атомных масс и при этом обнаружил связь свойств химических элементов с их атомными массами, которая заключалась в том, что через определенные интервалы свойства элементов повторялись. Д. И. Менделеев сформулировал периодический закон так: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
Несмотря на всю огромную значимость такого вывода, ПЗ и ПС представляли лишь гениальное эмпирическое (экспериментальное) обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого в том, что в 19 в совершенно отсутствовали представления о сложности строения атома.
Чаще используют три варианта ПС:
1. Короткопериодный;
2. Полудлинный (все элементы 4-го и 5-го периодов вытянуты в одну линию по 18 элементов;
3. Длиннопериодный (в одну линию вытянуты все s, p, d и f элементы.
Короткаяформа ПС состоит из 7 периодов и 8 групп.
Период – это горизонтальный ряд, который начинается щелочным металлом (кроме первого периода) и заканчивается инертным элементом (кроме седьмого периода).
Первый, второй и третий периоды состоят из одного ряда и называются малыми. Четвертый, пятый и шестой периоды состоят из двух рядов и называются большими. Всего в периодической системе 10 рядов. Верхний ряд - четный, нижний - нечетный. Четные ряды содержат только металлы и свойства элементов слева направо меняются мало. Четный ряд большого периода заканчивается тремя сходными между собой по свойствам элементами: триадами. Нечетные ряды содержат металлы и неметаллы, в них слева направо идет постепенный переход от металлических свойств к неметаллическим.
В шестом периоде послелантана La (№ 57) расположены 14 элементов со сходными свойствами(№ 58 - 71): лантаноиды. Все они реакционноспособные металлы, реагируют с водой, у них сильно выражена горизонтальная аналогия.
В седьмом периоде после актиния Ас (№89) аналогично расположены14 элементов (№90 - 103), подобных актинию: актиноиды. Ядра их атомов крайне неустойчивы, то есть являются радиоактивными.
Каждая группа состоит из двух подгрупп: главной и побочной.
Подгруппы, в которые входят элементы малых и больших периодов, называются главными (А). Подгруппы, в которые входят элементы только больших периодов, называются побочными (В). Подгруппы объединяют наиболее сходные между собой элементы.
Для элементов одной группы характерны следующие закономерности:
1. Все элементы, кроме благородных газов, образуют кислородные соединения.
2. Высшая валентность и высшая положительная степень окисления обычно соответствует номеру группы. Исключения: 1) в 8-й группе только у рутения Ru и Os валентность равна VIII; Cu +1 , Cu +2 ; O –2 ; F –1 .
3. Элементы главной подгруппы с IV по VIII группы образуют летучие соединения с водородом. Валентность их в этих соединениях равна разности между числом 8 и номером группы. Например, N находится в V-й группе и его валентность равна 8 – 5 = 3 в соединении NH 3 .
Строение атома
В XIX в. считали, что атом – неделимая частица, которая не изменяется при химических реакциях. В концеХIХ- начале XX вв. были открыты рентгеновское излучение (немецким ученым К. Рентгеном, 1895 г), радиоактивность (французским ученым А. Беккерелем, 1896), электрон (английским ученым Дж. Томсоном, 1897 г.). Масса m(е)=9,109×10 –28 г и отрицательный заряд q(e)=1,602×10 –19 Кл. Величина заряда электрона принята за единицу элементарного электрического заряда.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой положительный заряд равномерно распределен по объему атома и нейтрализован вкрапленными в него электронами. Развивая эти представления, Э. Резерфорд в 1911г. предложил планетарную модель строения атома. По этой теории в центре атома находится положительно заряженное ядро, вокруг которого движутся электроны. Совокупность электронов в атоме называется его электронной оболочкой. В 1913 г. Английский ученый Д. Мозли обнаружил, что величина положительного заряда ядра атома равна порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Атом электронейтрален, следовательно, число электронов в электронной оболочке атома равно заряду ядра Z или порядковому номеру элемента в периодической системе .
В 1932 г. советские ученые Д. Д. Иваненко и Е. Н. Гапон и, независимо от ниx, немецкий ученый В. Гейзенберг создали протонно-нейтронную теорию строения ядра
. Протон
р - это частица с массой, равной 1 а. е. м.
(1,66 ×10 –24 г), и зарядом + 1. Нейтрон
n – это электронейтральная частица массой, близкой к массе протона. Протоны и нейтроны называют нуклонами.
Заряд ядра атома определяется числом протонов. Следовательно, число протонов в ядре атома также равно порядковому номеру элемента в периодической системе . Общее число протонов и нейтронов называется массовым числом (А). Оно равно округленному до целого числа значению относительной атомной массы.
Задание. Какой заряд ядра и сколько электронов, протонов, нейтронов в атоме цинка?
Z=+30, p=30, e=30, n = 65–30 = 35.
Изотопы
Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами (одинаковым числом протонов и разным числом нейтронов), называются изотопами. Химические свойства всех изотопов одного элемента одинаковы.
Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, элемент водород имеет три изотопа. Н – протий (1 р); D ( Н) - дейтерий (1р, 1 n); T ( Н) - тритий (1 р, 2 n).
Часть 1
2. Рассмотрим пример.
Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.

Часть II
1. Заполните пропуски, проанализировав уравнение реакции.

2. Рассчитайте массу магния, который может сгореть в кислороде объёмом 33,6 л (н. у.). Схема химической реакции:

3. В реакцию вступили 13 г цинка и соляная кислота. В результате реакции образовались водород и хлорид цинка. Определите объём (н. у.) и число молекул водорода.

4. Навеска 1,12 г железа полностью «растворилась» в растворе сульфата меди (II). Вычислите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (II) получилось при этом?

5. Вычислите массу гидроксида меди (II), который образуется при взаимодействии 200 г 20%-го раствора гидроксида натрия и избытка раствора сульфата меди (II). В результате реакции образуется также сульфат натрия.

6. Определите объём азота N2, необходимого для взаимодействия с кислородом, если в результате реакции получается 250 мл оксида азота (II).

7. Какой объём воздуха потребуется для взаимодействия 17,5 г лития, содержащего 20% примесей? В результате реакции получается оксид лития.

8. Придумайте задачу, при решении которой необходимо использовать следующую схему реакции:
Запишите условие задачи и решите её.
При взаимодействии 2 моль серной кислоты с нитратом свинца, образовался осадок, найти его массу.
Расчеты по химическим уравнениям
Закирова Олися Тельмановна –учитель химии.
9 класс
Цели урока: Сформировать знания о способах решения задач по химическим уравнениям: находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ, Развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы, навыки работы с текстом задачи, умение выбирать способ решения учебной задачи, умения составлять уравнения химических реакций. Воспитывать самостоятельность в принятии решений, умение оценить результаты.
Ход и содержание урока
I Организационный момент. Здравствуйте ребята. Сегодня, очень интересный урок по решению задач.
II. Актуализация знаний, умений, навыков.
Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы знаете признаки указывающие на протекание химических реакций, умеете составлять уравнения химических реакций.
1.Перечислите признаки химических превращений:
2.Установите соответствие.
4Al + 3O 2 = 2Al 2 O 3 а) уравнения реакций соединения
MgCO 3 = MgO + CO 2 б) уравнения реакций замещения
2HgO = 2Hg + O 2: в) уравнения реакций разложения
2Na + S=Na 2 S
Zn + Br 2 = ZnBr2
Zn + 2HCl = ZnCl 2 + H 2
Fe + CuSO 4 =FeSO 4 +Cu
III . Усвоение новых знаний. Для того чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом - сделать пять шагов:
1. Составить уравнение
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения
(только для чистых веществ, то есть не содержащих принеси). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала надо определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакции.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
V(0 2)=?л(н.у.)
М(Н 2 О)=18 г/моль
Vm=22,4л/моль Запишем уравнение реакции. Расставим коэффициенты
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ - стехиометрические соотношения, отображаемые химическим уравнением
0,5моль - х моль
2Н 2 О = 2Н 2 + О 2
2моль - 1моль
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
![]()
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
V(0 2)=n(0 2) Vm
V(O 2)=0,25моль 22,4л/моль=5,6л (н. у.)
Ответ: 5,6 л
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
М(Н 2 О) = 18 г/моль
М(О 2) = 32 г/моль
Запишем уравнение химической реакции:
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ -стехиометрические соотношения, отображаемые химическим уравнением
0,5моль х моль
2Н 2 О = 2Н 2 + О 2
2моль 1моль
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
0,5моль = хмоль
2моль 1моль
откуда х = 0,25 моль Следовательно, n(O 2 )=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 моль 32 г/моль = 8 г
Запишем ответ
Ответ: m(О 2) = 8 г
I V .Закрепление изученного материала. Какой объем воздуха (н.у) потребуется для взаимодействия с 270 гр. , содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
V .Домашнее задание:
1 уровень Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
2 уровень При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
3 уровень Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na 2 CO 3 , необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?

 моль
моль моль
моль


 моль
моль моль
моль