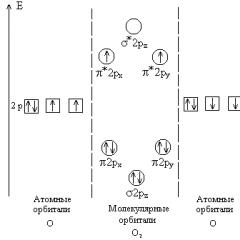
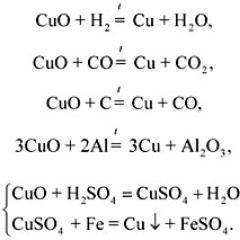रेडॉक्स प्रतिक्रियाओं की रचना के नियम। रेडॉक्स प्रतिक्रियाओं को संकलित करने के नियम एनोड पर होने वाली प्रक्रियाएं
आइए याद रखें कि कमी प्रक्रियाएँ कैथोड पर होती हैं, और ऑक्सीकरण प्रक्रियाएँ एनोड पर होती हैं।
कैथोड पर होने वाली प्रक्रियाएँ:
समाधान में कई प्रकार के धनात्मक आवेशित कण होते हैं जिन्हें कैथोड पर कम किया जा सकता है:
1) यदि धातु एल्युमीनियम के दाहिनी ओर तनाव श्रृंखला में है (अल को शामिल नहीं करते हुए) तो धातु धनायन एक साधारण पदार्थ में बदल जाते हैं। उदाहरण के लिए:
Zn 2+ +2e → Zn 0।
2) नमक या क्षार के घोल के मामले में: यदि धातु एच 2 तक धातु वोल्टेज की श्रृंखला में है तो हाइड्रोजन धनायन एक साधारण पदार्थ में कम हो जाते हैं:
2H 2 O + 2e → H 2 0 + 2OH -।
उदाहरण के लिए, NaNO3 या KOH विलयनों के इलेक्ट्रोलिसिस के मामले में।
3) एसिड समाधान के इलेक्ट्रोलिसिस के मामले में: हाइड्रोजन धनायन एक साधारण पदार्थ में कम हो जाते हैं:
2H + +2e → H 2।
उदाहरण के लिए, H2SO4 के घोल के इलेक्ट्रोलिसिस के मामले में।
एनोड पर होने वाली प्रक्रियाएँ:
एसिड अवशेष जिनमें ऑक्सीजन नहीं होता है, एनोड पर आसानी से ऑक्सीकृत हो जाते हैं। उदाहरण के लिए, हैलाइड आयन (एफ - को छोड़कर), सल्फाइड आयन, हाइड्रॉक्साइड आयन और पानी के अणु:
1) हैलाइड आयन सरल पदार्थों में ऑक्सीकृत हो जाते हैं:
2सीएल - - 2ई → सीएल 2।
2) हाइड्रॉक्साइड आयनों में क्षार समाधान के इलेक्ट्रोलिसिस के मामले में, ऑक्सीजन एक साधारण पदार्थ में ऑक्सीकृत हो जाता है। हाइड्रोजन की ऑक्सीकरण अवस्था पहले से ही +1 है और इसे आगे ऑक्सीकरण नहीं किया जा सकता है। पानी भी छोड़ा जाएगा - क्यों? क्योंकि हम और कुछ नहीं लिख पाएंगे: 1) हम H + नहीं लिख सकते, क्योंकि OH - और H + एक ही समीकरण के विपरीत पक्षों पर खड़े नहीं हो सकते हैं; 2) हम H 2 भी नहीं लिख सकते, क्योंकि यह हाइड्रोजन कमी (2H + +2e → H 2) की एक प्रक्रिया होगी, और एनोड पर केवल ऑक्सीकरण प्रक्रियाएं होती हैं।
4OH - - 4e → O 2 + 2H 2 O.
3) यदि समाधान में फ्लोरीन आयन या कोई ऑक्सीजन युक्त आयन शामिल हैं, तो पानी निम्नलिखित समीकरण के अनुसार एनोड स्थान के अम्लीकरण के साथ ऑक्सीकरण से गुजरेगा:
2H 2 O - 4e → O 2 + 4H +।
यह प्रतिक्रिया ऑक्सीजन युक्त लवण या ऑक्सीजन युक्त एसिड के समाधान के इलेक्ट्रोलिसिस के मामले में होती है। क्षार समाधान के इलेक्ट्रोलिसिस के मामले में, हाइड्रॉक्साइड आयनों को उपरोक्त नियम 2) के अनुसार ऑक्सीकरण किया जाएगा।
4) एनोड पर कार्बनिक अम्ल नमक के घोल के इलेक्ट्रोलिसिस के मामले में, CO 2 हमेशा जारी होता है और कार्बन श्रृंखला अवशेष दोगुना हो जाता है:
2R-COO - - 2e → R-R + 2CO 2।
उदाहरण:
1. समाधानसोडियम क्लोराइड
NaCl → Na + + Cl -
धातु Na एल्यूमीनियम से पहले वोल्टेज श्रृंखला में है, इसलिए, इसे कैथोड पर कम नहीं किया जाएगा (धनायन समाधान में रहते हैं)। उपरोक्त नियम के अनुसार, कैथोड पर हाइड्रोजन कम हो जाता है। क्लोराइड आयन एनोड पर एक साधारण पदार्थ में ऑक्सीकरण करेंगे:
को: 2Na+ (समाधान में)
ए: 2सीएल - - 2ई → सीएल 2
Na+ के सामने गुणांक 2 क्लोराइड आयनों के सामने समान गुणांक की उपस्थिति के कारण प्रकट हुआ, क्योंकि NaCl नमक में उनका अनुपात 1:1 है।
हम जाँचते हैं कि प्राप्त और दिए गए इलेक्ट्रॉनों की संख्या समान है, और कैथोड और एनोड प्रक्रियाओं के बाएँ और दाएँ भागों का योग करते हैं:
2Na + + 2Cl - + 2H 2 O → H 2 0 + 2Na + + 2OH - + सीएल 2। हम धनायनों और ऋणायनों को जोड़ते हैं:
2NaCl + 2H 2 O → H 2 0 + 2NaOH + Cl 2।
2. समाधानना 2अतः 4
हम आयनों में पृथक्करण का वर्णन करते हैं:
Na 2 SO 4 → 2Na + + SO 4 2-
सोडियम एल्यूमीनियम से पहले वोल्टेज श्रृंखला में है, इसलिए, इसे कैथोड पर कम नहीं किया जाएगा (धनायन समाधान में रहते हैं)। उपरोक्त नियम के अनुसार कैथोड पर केवल हाइड्रोजन का अपचयन होता है। सल्फेट आयनों में ऑक्सीजन होता है, इसलिए वे ऑक्सीकरण नहीं करेंगे, घोल में भी बने रहेंगे। उपरोक्त नियम के अनुसार, इस मामले में पानी के अणुओं का ऑक्सीकरण होता है:
को: 2H 2 O + 2e → H 2 0 + 2OH -
ए: 2H 2 O - 4e → O 2 0 + 4H +।
हम कैथोड और एनोड पर प्राप्त और प्रसारित इलेक्ट्रॉनों की संख्या को बराबर करते हैं। ऐसा करने के लिए, कैथोडिक प्रक्रिया के सभी गुणांकों को 2 से गुणा करना आवश्यक है:
को: 4H 2 O + 4e → 2H 2 0 + 4OH -
ए: 2H 2 O - 4e → O 2 0 + 4H +।
6H 2 O → 2H 2 0 + 4OH - + 4H + + O 2 0।
4OH- और 4H+ को H2O के 4 अणुओं में संयोजित किया जाता है:
6H 2 O → 2H 2 0 + 4H 2 O + O 2 0.
हम समीकरण के दोनों ओर स्थित पानी के अणुओं को कम करते हैं, अर्थात। समीकरण के प्रत्येक पक्ष से 4H 2 O घटाएं और अंतिम हाइड्रोलिसिस समीकरण प्राप्त करें:
2H 2 O → 2H 2 0 + O 2 0.
इस प्रकार, सक्रिय धातुओं (एएल समावेशी तक) के ऑक्सीजन युक्त लवणों के समाधान की हाइड्रोलिसिस पानी की हाइड्रोलिसिस तक कम हो जाती है, क्योंकि न तो धातु धनायन और न ही अम्लीय अवशेषों के आयन इलेक्ट्रोड पर होने वाली रेडॉक्स प्रक्रियाओं में भाग लेते हैं।
3. समाधानCuCl2
हम आयनों में पृथक्करण का वर्णन करते हैं:
CuCl 2 → Cu 2+ + 2Cl -
कॉपर हाइड्रोजन के बाद धातुओं की वोल्टेज श्रृंखला में है, इसलिए, यह केवल कैथोड पर कम हो जाएगा। एनोड पर केवल क्लोराइड आयनों का ऑक्सीकरण किया जाएगा।
को:
Cu 2+ + 2e → Cu 0
ए: 2सीएल - - 2ई → सीएल 2
CuCl 2 → Cu 0 + Cl 2।
4. समाधानCuSO4
हम आयनों में पृथक्करण का वर्णन करते हैं:
CuSO 4 → Cu 2+ + SO 4 2-
कॉपर हाइड्रोजन के बाद धातुओं की वोल्टेज श्रृंखला में है, इसलिए, यह केवल कैथोड पर कम हो जाएगा। पानी के अणुओं को एनोड पर ऑक्सीकृत किया जाएगा, क्योंकि एनोड पर समाधान में ऑक्सीजन युक्त एसिड अवशेष ऑक्सीकृत नहीं होते हैं।
को: Cu 2+ + 2e → Cu 0
ए:एसओ 4 2- (समाधान में)
2H 2 O - 4e → O 2 + 4H +।
हम कैथोड और एनोड पर इलेक्ट्रॉनों की संख्या को बराबर करते हैं। ऐसा करने के लिए, हम कैथोड समीकरण के सभी गुणांकों को 2 से गुणा करते हैं। सल्फेट आयनों की संख्या भी दोगुनी होनी चाहिए, क्योंकि कॉपर सल्फेट में Cu 2+ और SO 4 2- 1:1 का अनुपात होता है।
को: 2Cu 2+ + 4e → 2Cu 0
ए: 2SO 4 2- (समाधान में)
2H 2 O - 4e → O 2 + 4H +।
हम समग्र समीकरण लिखते हैं:
2Cu 2+ + 2SO 4 2- + 2H 2 O → 2Cu 0 + O 2 + 4H + + 2SO 4 2-।
धनायनों और ऋणायनों को मिलाकर, हम अंतिम इलेक्ट्रोलिसिस समीकरण प्राप्त करते हैं:
2CuSO 4 + 2H 2 O → 2Cu 0 + O 2 + 2H 2 SO 4।
5. समाधानNiCl2
हम आयनों में पृथक्करण का वर्णन करते हैं:
NiCl 2 → Ni 2+ + 2Cl -
निकेल एल्यूमीनियम के बाद और हाइड्रोजन से पहले धातुओं की वोल्टेज श्रृंखला में है, इसलिए, धातु और हाइड्रोजन दोनों कैथोड पर कम हो जाएंगे। एनोड पर केवल क्लोराइड आयनों का ऑक्सीकरण किया जाएगा।
को:
नी 2+ + 2इ → नी 0
2H 2 O + 2e → H 2 0 + 2OH -
ए: 2सीएल - - 2ई → सीएल 2
हम कैथोड और एनोड पर प्राप्त और छोड़े गए इलेक्ट्रॉनों की संख्या को बराबर करते हैं। ऐसा करने के लिए, एनोड समीकरण के सभी गुणांकों को 2 से गुणा करें:
को:नी 2+ + 2इ → नी 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (समाधान में)
ए: 4Cl - - 4e → 2Cl 2
हम ध्यान दें कि सूत्र NiCl 2 के अनुसार, निकल और क्लोरीन परमाणुओं का अनुपात 1: 2 है, इसलिए, 2NiCl 2 की कुल मात्रा प्राप्त करने के लिए समाधान में Ni 2+ जोड़ा जाना चाहिए। यह भी किया जाना चाहिए, क्योंकि समाधान में हाइड्रॉक्साइड आयनों के लिए काउंटर मौजूद होना चाहिए।
हम कैथोडिक और एनोडिक प्रक्रियाओं के बाएँ और दाएँ भागों को जोड़ते हैं:
Ni 2+ + Ni 2+ + 4Cl - + 2H 2 O → Ni 0 + H 2 0 + 2OH - + Ni 2+ + 2Cl 2।
हम अंतिम इलेक्ट्रोलिसिस समीकरण प्राप्त करने के लिए धनायनों और आयनों को जोड़ते हैं:
2NiCl 2 + 2H 2 O → Ni 0 + H 2 0 + Ni(OH) 2 + 2Cl 2।
6. समाधानNiSO4
हम आयनों में पृथक्करण का वर्णन करते हैं:
NiSO 4 → Ni 2+ + SO 4 2-
निकेल एल्यूमीनियम के बाद और हाइड्रोजन से पहले धातुओं की वोल्टेज श्रृंखला में है, इसलिए, धातु और हाइड्रोजन दोनों कैथोड पर कम हो जाएंगे। पानी के अणुओं को एनोड पर ऑक्सीकृत किया जाएगा, क्योंकि एनोड पर समाधान में ऑक्सीजन युक्त एसिड अवशेष ऑक्सीकृत नहीं होते हैं।
को:नी 2+ + 2इ → नी 0
2H 2 O + 2e → H 2 0 + 2OH -
ए:एसओ 4 2- (समाधान में)
2H 2 O - 4e → O 2 + 4H +।
हम जांचते हैं कि प्राप्त और दिए गए इलेक्ट्रॉनों की संख्या समान है। हम यह भी ध्यान देते हैं कि समाधान में हाइड्रॉक्साइड आयन हैं, लेकिन इलेक्ट्रोड प्रक्रियाओं के रिकॉर्ड में उनके लिए कोई काउंटर नहीं हैं। इसलिए, समाधान में Ni 2+ अवश्य मिलाया जाना चाहिए। चूँकि निकल आयनों की संख्या दोगुनी हो गई है, इसलिए सल्फेट आयनों की संख्या दोगुनी करना आवश्यक है:
को:नी 2+ + 2इ → नी 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (समाधान में)
ए: 2SO 4 2- (समाधान में)
2H 2 O - 4e → O 2 + 4H +।
हम कैथोडिक और एनोडिक प्रक्रियाओं के बाएँ और दाएँ भागों को जोड़ते हैं:
Ni 2+ + Ni 2+ + 2SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + Ni 2+ + 2OH - + H 2 0 + O 2 0 + 2SO 4 2- + 4H +।
हम धनायनों और ऋणायनों को जोड़ते हैं और अंतिम इलेक्ट्रोलिसिस समीकरण लिखते हैं:
2NiSO 4 + 4H 2 O → Ni 0 + Ni(OH) 2 + H 2 0 + O 2 0 + 2H 2 SO 4।
अन्य साहित्य स्रोत मध्यवर्ती गतिविधि के ऑक्सीजन युक्त धातु लवणों के इलेक्ट्रोलिसिस के वैकल्पिक पाठ्यक्रम के बारे में भी बात करते हैं। अंतर यह है कि इलेक्ट्रोलिसिस प्रक्रियाओं के बाएँ और दाएँ पक्षों को जोड़ने के बाद, दो पानी के अणुओं को बनाने के लिए H + और OH - को मिलाना आवश्यक है। शेष 2H+ सल्फ्यूरिक एसिड के निर्माण पर खर्च किया जाता है। इस मामले में, अतिरिक्त निकल और सल्फेट आयन जोड़ने की कोई आवश्यकता नहीं है:
Ni 2+ + SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + 2OH - + H 2 0 + O 2 0 + SO 4 2- + 4H +।
Ni 2+ + SO 4 2- + 4H 2 O → Ni 0 + H 2 0 + O 2 0 + SO 4 2- + 2H + + 2H 2 O.
अंतिम समीकरण:
NiSO 4 + 2H 2 O → Ni 0 + H 2 0 + O 2 0 + H 2 SO 4।
7. समाधानसीएच 3कूना
हम आयनों में पृथक्करण का वर्णन करते हैं:
सीएच 3 कूना → सीएच 3 सीओओ - + ना +
सोडियम एल्यूमीनियम से पहले वोल्टेज श्रृंखला में है, इसलिए, इसे कैथोड पर कम नहीं किया जाएगा (धनायन समाधान में रहते हैं)। उपरोक्त नियम के अनुसार कैथोड पर केवल हाइड्रोजन का अपचयन होता है। एनोड पर, एसीटेट आयनों का ऑक्सीकरण कार्बन डाइऑक्साइड के निर्माण और कार्बन श्रृंखला अवशेषों के दोगुना होने के साथ होगा:
को: 2Na+ (समाधान में)
2H 2 O + 2e → H 2 0 + 2OH -
ए: 2CH 3 COO - - 2e → CH 3 -CH 3 + CO 2
चूँकि ऑक्सीकरण और अपचयन की प्रक्रियाओं में इलेक्ट्रॉनों की संख्या समान होती है, इसलिए हम एक सारांश समीकरण बनाते हैं:
2Na + + 2CH 3 COO - + 2H 2 O → 2Na + + 2OH - + H 2 0 + CH 3 -CH 3 + CO 2
हम धनायनों और ऋणायनों को जोड़ते हैं:
2CH 3 COONa + 2H 2 O → 2NaOH + H 2 0 + CH 3 -CH 3 + CO 2।
8. समाधानएच 2अतः 4
हम आयनों में पृथक्करण का वर्णन करते हैं:
एच 2 एसओ 4 → 2 एच + + एसओ 4 2-
धनायनों में से केवल H+ धनायन ही विलयन में मौजूद हैं, और वे एक साधारण पदार्थ में परिवर्तित हो जायेंगे। एनोड पर पानी का ऑक्सीकरण होगा, क्योंकि एनोड पर समाधान में ऑक्सीजन युक्त अम्लीय अवशेष ऑक्सीकरण नहीं होते हैं।
को:
2H + +2e → H 2
ए: 2H 2 O - 4e → O 2 + 4H +
आइए इलेक्ट्रॉनों की संख्या को बराबर करें। ऐसा करने के लिए, हम कैथोडिक प्रक्रिया के समीकरण में प्रत्येक गुणांक को दोगुना करते हैं:
को:
4H + +4e → 2H 2
ए: 2H 2 O - 4e → O 2 + 4H +
आइए समीकरणों के बाएँ और दाएँ पक्षों का योग निकालें:
4H + + 2H 2 O → 2H 2 + O 2 + 4H +
प्रतिक्रिया के दोनों पक्षों में H+ धनायन पाए जाते हैं, इसलिए उन्हें कम करने की आवश्यकता होती है। हम पाते हैं कि एसिड समाधान के मामले में, केवल H2O अणु इलेक्ट्रोलिसिस से गुजरते हैं:
2H 2 O → 2H 2 + O 2.
9. समाधानNaOH
हम आयनों में पृथक्करण का वर्णन करते हैं:
NaOH → Na + + OH -
सोडियम एल्यूमीनियम से पहले वोल्टेज श्रृंखला में है, इसलिए, इसे कैथोड पर कम नहीं किया जाएगा (धनायन समाधान में रहते हैं)। नियम के अनुसार कैथोड पर केवल हाइड्रोजन का अपचयन होता है। एनोड पर, हाइड्रॉक्साइड आयन ऑक्सीजन और पानी बनाने के लिए ऑक्सीकरण करेंगे:
को: Na+ (समाधान में)
2H 2 O + 2e → H 2 0 + 2OH -
ए: 4OH - - 4e → O 2 + 2H 2 O
आइए इलेक्ट्रोड पर प्राप्त और छोड़े गए इलेक्ट्रॉनों की संख्या को बराबर करें:
को: Na+ (समाधान में)
4H 2 O + 4e → 2H 2 0 + 4OH -
ए: 4OH - - 4e → O 2 + 2H 2 O
आइए प्रक्रियाओं के बाएँ और दाएँ भागों को संक्षेप में प्रस्तुत करें:
4H 2 O + 4OH - → 2H 2 0 + 4OH - + O 2 0 + 2H 2 O
2H 2 O और OH - आयनों को कम करके, हम अंतिम इलेक्ट्रोलिसिस समीकरण प्राप्त करते हैं:
2H 2 O → 2H 2 + O 2.
निष्कर्ष:
1) ऑक्सीजन युक्त एसिड के समाधान के इलेक्ट्रोलिसिस के दौरान;
2) क्षार;
3) सक्रिय धातुओं के लवण और ऑक्सीजन युक्त अम्ल
पानी का इलेक्ट्रोलिसिस इलेक्ट्रोड पर होता है:
2H 2 O → 2H 2 + O 2.
जिस इलेक्ट्रोड पर कमी होती है उसे कैथोड कहा जाता है।
जिस इलेक्ट्रोड पर ऑक्सीकरण होता है वह एनोड है।
आइए ऑक्सीजन मुक्त एसिड के पिघले हुए लवणों के इलेक्ट्रोलिसिस के दौरान होने वाली प्रक्रियाओं पर विचार करें: एचसीएल, एचबीआर, एचआई, एच 2 एस (हाइड्रोफ्लोरिक या हाइड्रोफ्लोरिक एसिड - एचएफ के अपवाद के साथ)।
पिघले हुए भाग में, ऐसे नमक में अम्ल अवशेषों के धातु धनायन और आयन होते हैं।
उदाहरण के लिए, NaCl = Na++Cl -
कैथोड पर: ना + + ई = ना धात्विक सोडियम बनता है (सामान्य तौर पर, एक धातु जो नमक का हिस्सा है)
एनोड पर: 2सीएल - - 2ē = सीएल 2 क्लोरीन गैस बनती है (सामान्य तौर पर, एक हैलोजन जो एसिड अवशेष का हिस्सा होता है - फ्लोरीन - या सल्फर को छोड़कर)
आइए इलेक्ट्रोलाइट समाधानों के इलेक्ट्रोलिसिस के दौरान होने वाली प्रक्रियाओं पर विचार करें।
इलेक्ट्रोड पर होने वाली प्रक्रियाएं मानक इलेक्ट्रोड क्षमता के मूल्य और इलेक्ट्रोलाइट (नर्नस्ट समीकरण) की एकाग्रता से निर्धारित होती हैं। स्कूल पाठ्यक्रम इलेक्ट्रोलाइट एकाग्रता पर इलेक्ट्रोड क्षमता की निर्भरता पर विचार नहीं करता है और मानक इलेक्ट्रोड क्षमता के संख्यात्मक मूल्यों का उपयोग नहीं करता है। छात्रों के लिए यह जानना पर्याप्त है कि धातुओं के विद्युत रासायनिक तनाव की श्रृंखला (धातुओं की गतिविधि की श्रृंखला) में मी + एन / मी जोड़ी की मानक इलेक्ट्रोड क्षमता का मूल्य है:
- बाएँ से दाएँ बढ़ता है
- हाइड्रोजन तक की श्रृंखला में धातुओं का यह मान ऋणात्मक होता है
- हाइड्रोजन, प्रतिक्रिया द्वारा कमी पर 2Н + + 2ē = Н 2, (अर्थात एसिड से) में शून्य मानक इलेक्ट्रोड क्षमता होती है
- हाइड्रोजन के बाद की पंक्ति में धातुओं का यह मान धनात्मक होता है
! प्रतिक्रिया के अनुसार कमी के दौरान हाइड्रोजन:
2H 2 O + 2ē = 2OH - + एच 2 , (अर्थात् तटस्थ वातावरण में पानी से) मानक इलेक्ट्रोड क्षमता का ऋणात्मक मान -0.41 है
एनोड सामग्री घुलनशील (लोहा, क्रोमियम, जस्ता, तांबा, चांदी और अन्य धातु) और अघुलनशील - निष्क्रिय - (कोयला, ग्रेफाइट, सोना, प्लैटिनम) हो सकती है, इसलिए समाधान में एनोड के घुलने पर बनने वाले आयन होंगे:
मैं - nē = मैं +n
परिणामी धातु आयन इलेक्ट्रोलाइट समाधान में मौजूद होंगे और उनकी इलेक्ट्रोकेमिकल गतिविधि को भी ध्यान में रखना होगा।
इसके आधार पर, कैथोड पर होने वाली प्रक्रियाओं के लिए निम्नलिखित नियम निर्धारित किए जा सकते हैं:
1. इलेक्ट्रोलाइट धनायन एल्यूमीनियम सहित धातुओं की विद्युत रासायनिक वोल्टेज श्रृंखला में स्थित है, पानी में कमी की प्रक्रिया चल रही है:
2H 2 O + 2ē = 2OH - + एच 2
कैथोड स्थान में धातु धनायन विलयन में रहते हैं
2. इलेक्ट्रोलाइट धनायन एल्यूमीनियम और हाइड्रोजन के बीच स्थित होता है, इलेक्ट्रोलाइट की सांद्रता के आधार पर, या तो पानी की कमी की प्रक्रिया होती है या धातु आयनों की कमी की प्रक्रिया होती है। चूँकि कार्य में एकाग्रता निर्दिष्ट नहीं है, दोनों संभावित प्रक्रियाएँ दर्ज की जाती हैं:
2H 2 O + 2ē = 2OH - + एच 2
मी +एन + एनई = मी
3. इलेक्ट्रोलाइट धनायन - ये हाइड्रोजन आयन हैं, अर्थात। इलेक्ट्रोलाइट - एसिड. हाइड्रोजन आयन कम हो जाते हैं:
2Н + + 2ē = Н 2
4. इलेक्ट्रोलाइट धनायन हाइड्रोजन के बाद स्थित होता है, धातु धनायन कम हो जाते हैं।
मी +एन + एनई = मी
एनोड पर प्रक्रिया एनोड सामग्री और आयन की प्रकृति पर निर्भर करती है।
1. यदि एनोड घुल जाता है (उदाहरण के लिए, लोहा, जस्ता, तांबा, चांदी), तो एनोड की धातु ऑक्सीकृत हो जाती है।
मैं - nē = मैं +n
2. यदि एनोड निष्क्रिय है, अर्थात। अघुलनशील (ग्रेफाइट, सोना, प्लैटिनम):
ए) ऑक्सीजन मुक्त एसिड (फ्लोराइड्स को छोड़कर) के नमक के समाधान के इलेक्ट्रोलिसिस के दौरान, आयनों के ऑक्सीकरण की प्रक्रिया होती है;
2सीएल - - 2ē = सीएल 2
2ब्र - - 2ē = ब्र 2
2आई - - 2ē = मैं 2
एस 2 - - 2ē = एस
बी) क्षार समाधानों के इलेक्ट्रोलिसिस के दौरान, हाइड्रॉक्सो समूह OH - के ऑक्सीकरण की प्रक्रिया होती है:
4ओएच - - 4ē = 2H 2 O + O 2
ग) ऑक्सीजन युक्त एसिड के लवण के समाधान के इलेक्ट्रोलिसिस के दौरान: एचएनओ 3, एच 2 एसओ 4, एच 2 सीओ 3, एच 3 पीओ 4 और फ्लोराइड, पानी के ऑक्सीकरण की प्रक्रिया होती है।
2H 2 O - 4ē = 4H + + O 2
डी) एसीटेट (एसिटिक या एथेनोइक एसिड के लवण) के इलेक्ट्रोलिसिस के दौरान, एसीटेट आयन ईथेन और कार्बन मोनोऑक्साइड (IV) - कार्बन डाइऑक्साइड में ऑक्सीकृत हो जाता है।
2सीएच 3 सीओओ - - 2ē = सी 2 एच 6 + 2सीओ 2
कार्यों के उदाहरण.
1. नमक के सूत्र और उसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान निष्क्रिय एनोड पर बनने वाले उत्पाद के बीच एक पत्राचार स्थापित करें।
नमक फार्मूला
ए) NiSO 4
बी) NaClO 4
बी) LiCl
डी) आरबीबीआर
एनोड पर उत्पाद
1) एस 2) एसओ 2 3) सीएल 2 4) ओ 2 5) एच 2 6) बीआर 2
समाधान:
चूँकि असाइनमेंट एक अक्रिय एनोड को निर्दिष्ट करता है, हम केवल उन परिवर्तनों पर विचार करते हैं जो लवण के पृथक्करण के दौरान बने अम्लीय अवशेषों के साथ होते हैं:
एसओ 4 2 - ऑक्सीजन युक्त अम्ल का अम्लीय अवशेष। पानी के ऑक्सीकरण की प्रक्रिया होती है और ऑक्सीजन निकलती है। उत्तर - 4
सीएलओ4 - ऑक्सीजन युक्त अम्ल का अम्लीय अवशेष। पानी के ऑक्सीकरण की प्रक्रिया होती है और ऑक्सीजन निकलती है। उत्तर - 4।
क्लोरीन - ऑक्सीजन मुक्त अम्ल का अम्लीय अवशेष। अम्लीय अवशेषों के ऑक्सीकरण की प्रक्रिया स्वयं चल रही है। क्लोरीन निकलता है. उत्तर 3.
बीआर - ऑक्सीजन मुक्त अम्ल का अम्लीय अवशेष। अम्लीय अवशेषों के ऑक्सीकरण की प्रक्रिया स्वयं चल रही है। ब्रोमीन निकलता है. उत्तर 6.
सामान्य उत्तर: 4436
2. नमक के सूत्र और उसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड पर बनने वाले उत्पाद के बीच एक पत्राचार स्थापित करें।
नमक फार्मूला
ए) अल(NO 3) 3
बी) एचजी(एनओ 3) 2
बी) Cu(NO 3) 2
डी) नैनो 3
एनोड पर उत्पाद
1) हाइड्रोजन 2) एल्युमिनियम 3) पारा 4) तांबा 5) ऑक्सीजन 6) सोडियम
समाधान:
चूँकि कार्य कैथोड को निर्दिष्ट करता है, हम केवल उन परिवर्तनों पर विचार करते हैं जो लवण के पृथक्करण के दौरान बने धातु धनायनों के साथ होते हैं:
अल 3+ धातु वोल्टेज की इलेक्ट्रोकेमिकल श्रृंखला में एल्यूमीनियम की स्थिति के अनुसार (श्रृंखला की शुरुआत से एल्यूमीनियम सहित), पानी में कमी की प्रक्रिया होगी। हाइड्रोजन निकलती है. उत्तर 1।
एचजी 2+ पारे की स्थिति के अनुसार (हाइड्रोजन के बाद) पारे के आयनों में कमी की प्रक्रिया घटित होगी। बुध का योग बनता है. उत्तर 3.
Cu 2+ तांबे की स्थिति के अनुसार (हाइड्रोजन के बाद), तांबे के आयनों की कमी की प्रक्रिया होगी। उत्तर - 4।
ना+ सोडियम की स्थिति के अनुसार (पंक्ति की शुरुआत से लेकर एल्युमीनियम सहित), पानी कम करने की प्रक्रिया होगी। उत्तर 1।
सामान्य उत्तर: 1341
समाधानों का इलेक्ट्रोलिसिस
और पिघला हुआ नमक (2 घंटे)
वैकल्पिक पाठ्यक्रम "इलेक्ट्रोकैमिस्ट्री"
पहले पाठ के उद्देश्य:
प्रथम पाठ योजना
1. धातु प्राप्त करने के लिए अध्ययन की गई विधियों की पुनरावृत्ति।
2. नई सामग्री की व्याख्या.
3. जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन "रसायन विज्ञान -9" (एम.: प्रोस्वेशचेनी, 2002), पी द्वारा पाठ्यपुस्तक से समस्याओं का समाधान। 120, क्रमांक 1, 2.
4. परीक्षण कार्यों पर ज्ञान अर्जन का परीक्षण करना।
5. इलेक्ट्रोलिसिस के उपयोग पर रिपोर्ट.
पहले पाठ के उद्देश्य:विलयनों और पिघले हुए लवणों के इलेक्ट्रोलिसिस के लिए आरेख लिखना सिखाएं और गणना समस्याओं को हल करने के लिए अर्जित ज्ञान को लागू करें; पाठ्यपुस्तक और परीक्षण सामग्री के साथ काम करने में कौशल विकसित करना जारी रखें; राष्ट्रीय अर्थव्यवस्था में इलेक्ट्रोलिसिस के उपयोग पर चर्चा करें।
प्रथम पाठ की प्रगति
सीखे हुए तरीकों की पुनरावृत्ति धातुएँ प्राप्त करनाकॉपर (II) ऑक्साइड से तांबे के उत्पादन के उदाहरण का उपयोग करना।
संगत प्रतिक्रियाओं के समीकरण लिखना:

धातुओं को उनके लवणों के विलयन तथा पिघलने से प्राप्त करने का दूसरा तरीका है विद्युत, या इलेक्ट्रोलीज़.
इलेक्ट्रोलिसिस एक रेडॉक्स प्रक्रिया है जो इलेक्ट्रोड पर तब होती है जब पिघले या इलेक्ट्रोलाइट समाधान के माध्यम से विद्युत प्रवाह पारित किया जाता है.
सोडियम क्लोराइड पिघल का इलेक्ट्रोलिसिस:
NaCl Na + + Cl – ;
कैथोड (-) (Na+): Na++ इ=ना0,
एनोड (-) (सीएल-): सीएल-- इ= सीएल 0, 2सीएल 0 = सीएल 2;
2NaCl = 2Na +Cl2.
सोडियम क्लोराइड समाधान का इलेक्ट्रोलिसिस:
NaCl Na + + Cl – ,
एच 2 ओ एच + + ओएच – ;
कैथोड (-) (Na + ; H +): H + + इ= एच 0 , 2 एच 0 = एच 2
(2एच2ओ+2 इ= एच 2 + 2ओएच -),
एनोड (+) (सीएल - ; ओН -): सीएल - - इ= सीएल 0, 2सीएल 0 = सीएल 2;
2NaCl + 2H 2 O = 2NaOH + Cl 2 + H 2।
कॉपर (II) नाइट्रेट समाधान का इलेक्ट्रोलिसिस:
Cu(NO 3) 2 Cu 2+ +
एच 2 ओ एच + + ओएच – ;
कैथोड (-) (Cu 2+; H +): Cu 2+ + 2 इ= घन 0 ,
एनोड (+) (OH -): OH - - इ=ओह 0,
4एच 0 = ओ 2 + 2एच 2 ओ;
2Cu(NO 3) 2 + 2H 2 O = 2Cu + O 2 + 4HNO 3.
ये तीन उदाहरण दिखाते हैं कि धातुओं के उत्पादन के अन्य तरीकों की तुलना में इलेक्ट्रोलिसिस अधिक लाभदायक क्यों है: धातु, हाइड्रॉक्साइड, एसिड और गैसें प्राप्त की जाती हैं।
हमने इलेक्ट्रोलिसिस आरेख लिखे, और अब आइए आरेखों का संदर्भ दिए बिना, केवल आयन गतिविधि पैमाने का उपयोग करके, तुरंत इलेक्ट्रोलिसिस समीकरण लिखने का प्रयास करें:
इलेक्ट्रोलिसिस समीकरणों के उदाहरण:
2HgSO 4 + 2H 2 O = 2Hg + O 2 + 2H 2 SO 4;
Na 2 SO 4 + 2H 2 O = Na 2 SO 4 + 2H 2 + O 2;
2LiCl + 2H 2 O = 2LiOH + H 2 + सीएल 2।
समस्या को सुलझानाजी.ई. रुडज़ाइटिस और एफ.जी. फेल्डमैन की पाठ्यपुस्तक से (9वीं कक्षा, पृष्ठ 120, संख्या 1, 2)।
कार्य 1।कॉपर (II) क्लोराइड के घोल के इलेक्ट्रोलिसिस के दौरान, कैथोड का द्रव्यमान 8 ग्राम बढ़ गया। कौन सी गैस निकली, इसका द्रव्यमान क्या है?
समाधान
CuCl 2 + H 2 O = Cu + Cl 2 + H 2 O,
(Cu) = 8/64 = 0.125 mol,
(Cu) = (Cl 2) = 0.125 mol,
एम(सीएल 2) = 0.125 71 = 8.875 ग्राम।
उत्तर. गैस - क्लोरीन वजन 8.875 ग्राम।
कार्य 2.सिल्वर नाइट्रेट के जलीय घोल के इलेक्ट्रोलिसिस के दौरान 5.6 लीटर गैस निकली। कैथोड पर कितने ग्राम धातु जमा होती है?
समाधान
4AgNO 3 + 2H 2 O = 4Ag + O 2 + 4HNO 3,
(ओ 2) = 5.6/22.4 = 0.25 मोल,
(एजी) = 4(ओ 2) = 4 25 = 1 मोल,
एम(एजी) = 1,107 = 107 ग्राम।
उत्तर. 107 ग्राम चांदी.
परिक्षण
विकल्प 1
1. कैथोड पर पोटेशियम हाइड्रॉक्साइड के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) हाइड्रोजन; बी) ऑक्सीजन; ग) पोटैशियम।
2. घोल में कॉपर (II) सल्फेट के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित बनता है:
ए) कॉपर (II) हाइड्रॉक्साइड;
बी) सल्फ्यूरिक एसिड;
3. एनोड पर बेरियम क्लोराइड समाधान के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) हाइड्रोजन; बी) क्लोरीन; ग) ऑक्सीजन।
4. कैथोड पर पिघले हुए एल्यूमीनियम क्लोराइड के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) एल्यूमीनियम; बी) क्लोरीन;
ग) इलेक्ट्रोलिसिस असंभव है।
5. सिल्वर नाइट्रेट घोल का इलेक्ट्रोलिसिस निम्नलिखित योजना के अनुसार होता है:
ए) एग्नो 3 + एच 2 ओ एजी + एच 2 + एचएनओ 3;
बी) एग्नो 3 + एच 2 ओ एजी + ओ 2 + एचएनओ 3;
सी) एग्नो 3 + एच 2 ओ एग्नो 3 + एच 2 + ओ 2।
विकल्प 2
1. एनोड पर सोडियम हाइड्रॉक्साइड समाधान के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) सोडियम; बी) ऑक्सीजन; ग) हाइड्रोजन।
2. घोल में सोडियम सल्फाइड के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित बनता है:
ए) हाइड्रोसल्फाइड एसिड;
बी) सोडियम हाइड्रॉक्साइड;
3. कैथोड पर पारा (II) क्लोराइड के पिघलने के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
क) पारा; बी) क्लोरीन; ग) इलेक्ट्रोलिसिस असंभव है।
4.
5. पारा (II) नाइट्रेट के घोल का इलेक्ट्रोलिसिस निम्नलिखित योजना के अनुसार होता है:
ए) एचजी(एनओ 3) 2 + एच 2 ओ एचजी + एच 2 + एचएनओ 3;
बी) एचजी(एनओ 3) 2 + एच 2 ओ एचजी + ओ 2 + एचएनओ 3;
सी) एचजी(एनओ 3) 2 + एच 2 ओ एचजी(एनओ 3) 2 + एच 2 + ओ 2।
विकल्प 3
1. कैथोड पर कॉपर (II) नाइट्रेट के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित निकलता है:
क) तांबा; बी) ऑक्सीजन; ग) हाइड्रोजन।
2. घोल में लिथियम ब्रोमाइड के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित बनता है:
बी) हाइड्रोब्रोमिक एसिड;
ग) लिथियम हाइड्रॉक्साइड।
3. कैथोड पर पिघले हुए सिल्वर क्लोराइड के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) चांदी; बी) क्लोरीन; ग) इलेक्ट्रोलिसिस असंभव है।
4. एल्यूमीनियम क्लोराइड समाधान के इलेक्ट्रोलिसिस के दौरान, एल्यूमीनियम को छोड़ा जाता है:
ए) कैथोड; बी) एनोड; ग) घोल में रहता है।
5. बेरियम ब्रोमाइड घोल का इलेक्ट्रोलिसिस निम्नलिखित योजना के अनुसार होता है:
ए) BaBr 2 + H 2 O Br 2 + H 2 + Ba(OH) 2;
बी) BaBr 2 + H 2 O Br 2 + Ba + H 2 O;
सी) BaBr 2 + H 2 O Br 2 + O 2 + Ba(OH) 2।
विकल्प 4
1. एनोड पर बेरियम हाइड्रॉक्साइड समाधान के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) हाइड्रोजन; बी) ऑक्सीजन; ग) बेरियम।
2. घोल में पोटेशियम आयोडाइड के घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित बनता है:
ए) हाइड्रोआयोडिक एसिड;
बी) पानी; ग) पोटेशियम हाइड्रॉक्साइड।
3. कैथोड पर पिघले हुए लेड (II) क्लोराइड के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित निकलता है:
एक सुराग़; बी) क्लोरीन; ग) इलेक्ट्रोलिसिस असंभव है।
4. कैथोड पर सिल्वर नाइट्रेट घोल के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित जारी होता है:
ए) चांदी; बी) हाइड्रोजन; ग) ऑक्सीजन।
5. सोडियम सल्फाइड घोल का इलेक्ट्रोलिसिस निम्नलिखित योजना के अनुसार होता है:
ए) ना 2 एस + एच 2 ओ एस + एच 2 + NaOH;
बी) ना 2 एस + एच 2 ओ एच 2 + ओ 2 + ना 2 एस;
ग) Na 2 S + H 2 O H 2 + Na 2 S + NaOH।
जवाब
| विकल्प | प्रश्न 1 | प्रश्न 2 | प्रश्न 3 | प्रश्न 4 | प्रश्न 5 |
| 1 | ए | बी | बी | ए | बी |
| 2 | बी | बी | ए | ए | बी |
| 3 | ए | वी | ए | वी | ए |
| 4 | बी | वी | ए | ए | ए |
राष्ट्रीय अर्थव्यवस्था में इलेक्ट्रोलिसिस का अनुप्रयोग
1. धातु उत्पादों को जंग से बचाने के लिए, उनकी सतह पर किसी अन्य धातु की एक पतली परत लगाई जाती है: क्रोमियम, चांदी, सोना, निकल, आदि। कभी-कभी, महंगी धातुओं को बर्बाद न करने के लिए, एक बहुपरत कोटिंग का उत्पादन किया जाता है। उदाहरण के लिए, कार के बाहरी हिस्सों को पहले तांबे की एक पतली परत से लेपित किया जाता है, तांबे पर निकल की एक पतली परत लगाई जाती है और उसके ऊपर क्रोम की एक परत लगाई जाती है।
जब इलेक्ट्रोलिसिस द्वारा धातु पर कोटिंग लगाई जाती है, तो वे मोटाई में समान और टिकाऊ होते हैं। इस तरह, आप किसी भी आकार के उत्पादों को कोट कर सकते हैं। एप्लाइड इलेक्ट्रोकैमिस्ट्री की इस शाखा को कहा जाता है ELECTROPLATING.
2. जंग से बचाने के अलावा, गैल्वेनिक कोटिंग्स उत्पादों को एक सुंदर सजावटी स्वरूप देती हैं।
3. इलेक्ट्रोप्लेटिंग के सिद्धांत के समान इलेक्ट्रोकैमिस्ट्री की एक अन्य शाखा को गैल्वेनोप्लास्टी कहा जाता है। यह विभिन्न वस्तुओं की हूबहू प्रतिकृतियां बनाने की प्रक्रिया है। ऐसा करने के लिए, वस्तु को मोम से लेपित किया जाता है और एक मैट्रिक्स प्राप्त किया जाता है। मैट्रिक्स पर कॉपी की गई वस्तु के सभी खांचे उभरे हुए होंगे। मोम मैट्रिक्स की सतह ग्रेफाइट की एक पतली परत से लेपित होती है, जो इसे विद्युत प्रवाह के लिए प्रवाहकीय बनाती है।
परिणामी ग्रेफाइट इलेक्ट्रोड को कॉपर सल्फेट घोल के स्नान में डुबोया जाता है। एनोड तांबा है. इलेक्ट्रोलिसिस के दौरान, कॉपर एनोड घुल जाता है और कॉपर ग्रेफाइट कैथोड पर जमा हो जाता है। इस प्रकार हूबहू तांबे की प्रति प्राप्त हो जाती है।
इलेक्ट्रोप्लेटिंग का उपयोग प्रिंटिंग क्लिच, ग्रामोफोन रिकॉर्ड बनाने और विभिन्न वस्तुओं को धातुकृत करने के लिए किया जाता है। गैल्वेनोप्लास्टी की खोज रूसी वैज्ञानिक बी.एस. जैकोबी (1838) ने की थी।
रिकॉर्ड स्टैम्प बनाने में प्लास्टिक रिकॉर्ड को विद्युत प्रवाहकीय बनाने के लिए उस पर एक पतली चांदी की परत लगाना शामिल है। फिर प्लेट पर इलेक्ट्रोलाइटिक निकल कोटिंग लगाई जाती है।
इलेक्ट्रोलाइटिक बाथ में प्लेट किसकी बनी होनी चाहिए - एनोड या कैथोड?
(ओ टी वी ई टी. कैथोड।)
4. इलेक्ट्रोलिसिस का उपयोग कई धातुओं के उत्पादन के लिए किया जाता है: क्षार, क्षारीय पृथ्वी, एल्यूमीनियम, लैंथेनाइड्स, आदि।
5. कुछ धातुओं को अशुद्धियों से शुद्ध करने के लिए, अशुद्धियों वाली धातु को एनोड से जोड़ा जाता है। इलेक्ट्रोलिसिस के दौरान धातु घुल जाती है और धातु कैथोड पर निकल जाती है, जबकि अशुद्धता घोल में रहती है।
6. जटिल पदार्थों (क्षार, ऑक्सीजन युक्त एसिड) और हैलोजन के उत्पादन के लिए इलेक्ट्रोलिसिस का व्यापक रूप से उपयोग किया जाता है।
व्यावहारिक कार्य(दूसरा पाठ)
पाठ मकसद।पानी का इलेक्ट्रोलिसिस करें, व्यवहार में गैल्वनोस्टेजी प्रदर्शित करें और पहले पाठ में अर्जित ज्ञान को समेकित करें।
उपकरण।छात्रों के डेस्क पर: फ्लैट बैटरी, टर्मिनलों के साथ दो तार, दो ग्रेफाइट इलेक्ट्रोड, एक बीकर, टेस्ट ट्यूब, दो पैरों वाला एक स्टैंड, एक 3% सोडियम सल्फेट समाधान, एक अल्कोहल लैंप, माचिस, एक टॉर्च।
शिक्षक की मेज पर: वही + कॉपर सल्फेट का घोल, पीतल की चाबी, कॉपर ट्यूब (तांबे का टुकड़ा)।
छात्रों को निर्देश देना
1. टर्मिनलों के साथ तारों को इलेक्ट्रोड से जोड़ें।
2. इलेक्ट्रोडों को एक गिलास में रखें ताकि वे स्पर्श न करें।
3. एक गिलास में इलेक्ट्रोलाइट घोल (सोडियम सल्फेट) डालें।
4. परखनलियों में पानी डालें और, उन्हें इलेक्ट्रोलाइट वाले गिलास में उल्टा करके, उन्हें एक-एक करके ग्रेफाइट इलेक्ट्रोड पर रखें, तिपाई पैर में परखनली के ऊपरी किनारे को सुरक्षित करें।
5. डिवाइस माउंट होने के बाद, तारों के सिरों को बैटरी से जोड़ दें।
6. गैस के बुलबुले निकलने का निरीक्षण करें: उनमें से कैथोड की तुलना में एनोड पर कम बुलबुले निकलते हैं। एक टेस्ट ट्यूब में लगभग सारा पानी निकलने वाली गैस से बदल दिया जाए और दूसरे आधे में, बैटरी से तारों को डिस्कनेक्ट कर दें।
7. अल्कोहल लैंप जलाएं, टेस्ट ट्यूब को ध्यान से हटा दें, जहां से पानी लगभग पूरी तरह से विस्थापित हो गया है, और इसे अल्कोहल लैंप के पास लाएं - गैस की एक विशिष्ट पॉप सुनाई देगी।
8. एक टॉर्च जलाएं. दूसरी परखनली निकालें और सुलगती मशाल से गैस की जाँच करें।
छात्र कार्य
1. डिवाइस का स्केच बनाएं.
2. पानी के इलेक्ट्रोलिसिस के लिए एक समीकरण लिखें और बताएं कि सोडियम सल्फेट के घोल में इलेक्ट्रोलिसिस करना क्यों आवश्यक था।
3. इलेक्ट्रोड पर गैसों की रिहाई को दर्शाते हुए प्रतिक्रिया समीकरण लिखें।
शिक्षक प्रदर्शन प्रयोग
(कक्षा में सर्वश्रेष्ठ छात्रों द्वारा प्रदर्शन किया जा सकता है
यदि उपयुक्त उपकरण उपलब्ध हो)
1. तार टर्मिनलों को तांबे की ट्यूब और पीतल के रिंच से कनेक्ट करें।
2. ट्यूब और चाबी को कॉपर (II) सल्फेट के घोल वाले गिलास में रखें।
3. तारों के दूसरे सिरों को बैटरी से कनेक्ट करें: बैटरी का "माइनस" तांबे की ट्यूब से, "प्लस" कुंजी से!
4. चाबी की सतह पर तांबे के निकलने का निरीक्षण करें।
5. प्रयोग पूरा करने के बाद, पहले बैटरी से टर्मिनलों को डिस्कनेक्ट करें, फिर समाधान से चाबी हटा दें।
6. घुलनशील इलेक्ट्रोड के साथ इलेक्ट्रोलिसिस सर्किट को अलग करें:
CuSO 4 = Cu 2+ +
एनोड (+): Cu 0 - 2 इ= Cu2+ ,
कैथोड (-): Cu 2+ + 2 इ= घन 0 .
घुलनशील एनोड के साथ इलेक्ट्रोलिसिस के लिए समग्र समीकरण नहीं लिखा जा सकता है।
इलेक्ट्रोलिसिस कॉपर (II) सल्फेट के घोल में किया गया क्योंकि:
a) विद्युत धारा प्रवाहित करने के लिए इलेक्ट्रोलाइट घोल की आवश्यकता होती है, क्योंकि पानी एक कमजोर इलेक्ट्रोलाइट है;
बी) कोई प्रतिक्रिया उप-उत्पाद जारी नहीं किया जाएगा, लेकिन कैथोड पर केवल तांबा जारी किया जाएगा।
7. जो सीखा गया है उसे समेकित करने के लिए, कार्बन इलेक्ट्रोड के साथ जिंक क्लोराइड के इलेक्ट्रोलिसिस का एक आरेख लिखें:
ZnCl 2 = Zn 2+ + 2Cl – ,
कैथोड (-): Zn 2+ + 2 इ= Zn 0 ,
2H2O+2 इ= एच 2 + 2ओएच - ,
एनोड (+): 2Cl – – 2 इ=Cl2.
इस मामले में समग्र प्रतिक्रिया समीकरण नहीं लिखा जा सकता, क्योंकि यह अज्ञात है कि बिजली की कुल मात्रा का कितना हिस्सा पानी की बहाली के लिए जाता है, और कितना हिस्सा जिंक आयनों की बहाली के लिए जाता है।
 |
प्रदर्शन प्रयोग की योजना |
गृहकार्य
1. निष्क्रिय इलेक्ट्रोड के साथ कॉपर (II) नाइट्रेट और सिल्वर नाइट्रेट के मिश्रण वाले घोल के इलेक्ट्रोलिसिस के लिए एक समीकरण लिखें।
2. सोडियम हाइड्रॉक्साइड घोल के इलेक्ट्रोलिसिस के लिए समीकरण लिखें।
3. तांबे के सिक्के को साफ करने के लिए, इसे बैटरी के नकारात्मक ध्रुव से जुड़े तांबे के तार पर लटकाया जाना चाहिए और 2.5% NaOH समाधान में डुबोया जाना चाहिए, जहां बैटरी के सकारात्मक ध्रुव से जुड़े ग्रेफाइट इलेक्ट्रोड को भी डुबोया जाना चाहिए। बताएं कि सिक्का कैसे साफ होता है? ( उत्तर. हाइड्रोजन आयनों की कमी कैथोड पर होती है:
2एच++2 इ= एन 2.
हाइड्रोजन सिक्के की सतह पर स्थित कॉपर ऑक्साइड के साथ प्रतिक्रिया करता है:
CuO + H 2 = Cu + H 2 O.
यह तरीका पाउडर से सफाई करने से बेहतर है, क्योंकि... सिक्का मिटाया नहीं गया है.)