Аэробный синтез атф. Дыхательная цепь и синтез атф Атф синтетаза в митохондриях находится
АДФ + PO 4 3- + Е ⇔ АТФ
АТФ используется клетками как источник энергии во многих клеточных процессах. Та же самая реакция может идти и в обратном направлении, когда АТФ расщепляется на специальном белке-катализаторе обратно на АДФ и фосфат с выделением энергии.
АТФ-синтаза состоит из двух механизмов. Первый, F0, это электромотор, находящийся в клеточной мембране и превращающий энергию, запасенную в разности потенциалов по разные стороны клеточной мембраны. Липидная мембрана служит изолятором в этой электрохимической «батарейке»: через нее ионы не проходят. Разность потенциалов создается другими сложными механизмами в конечном счете из «сжигания» сахара в кислороде. Ион водорода H + втягивается во «впускной коллектор» и присоединяется к белковой дольке ротора. Ротор поворачивается за счет электростатических сил, а долька, достигшая «выхлопного коллектора» мотора, освобождается от иона каталитическим белком, и этот ион проваливается внутрь клетки, опять же за счет электростатических сил, стремящихся выровнять потенциал по обе стороны мембраны. Таким образом, электроэнергия сначала превращается в механическую энергию вращения молекулярного вала, присоединенного к ротору и уходящего вглубь клетки, к механизму синтеза, F1.
Механико-химический реактор F1 состоит из трех белковых долек, каждая из которых состоит из двух белковых молекул (их называют α-F1 и β-F1, а вал сделан из одной молекулы, обозначаемой γ-F1). Каждая долька может принимать две устойчивые пространственные конфигурации за счет взаимного межатомного притяжения - как обычный настенный выключатель оказывается в двух устойчивых положениях, хотя промежуточные положения неустойчивы. Одно из этих положений, однако, имеет более высокую энергию. Молекулы сдвигаются в конфигурацию с более высокой энергией за счет асимметрии вращающегося γ-вала, как будто бы «кулачком» на нем.
Когда к αβ-комплексу присоединяется АДФ и ион фосфата, равновесие нарушается, и молекула, как пружинка с запасенной энергией, перепрыгивает в состояние с меньшей энергией, а запасенная энергия тратится на сближение АДФ и фосфатного иона, в результате чего те соединяются в молекулу АТФ, в конечном счете уносящую этот запас энергии.
Вращение механизма можно увидеть в микроскоп, если присоединить к ротору в F0 специально изготовленную длинную светящуюся (флюоресцирующую) молекулу-стержень. В самом конце фильма можно увидеть реконструкцию этого потрясающего опыта Масасуке Ёсиды и врезку с данными, показывающими вращение ротора.
Интересно, что на нижнем конце ротора имеется еще один белок, δ-F1, который тоже умеет изменять конфигурацию в присутствии АДФ, исходного реагента для реакции. Когда АДФ вокруг реактора оказывается мало, этот белок меняет форму и заклинивает ротор, чтобы не расходовать электрохимическую энергию вхолостую, поскольку продвижение ионов H + через остановленный ротор невозможно. Да, и об экономии клеточной электроэнергии природа тоже «подумала»!
Больше информации о работе АТФ-синазы можно найти в
АТФ-синтаза состоит из двух механизмов. Первый, F0, это электромотор, находящийся в клеточной мембране и превращающий энергию, запасенную в разности потенциалов по разные стороны клеточной мембраны. Липидная мембрана служит изолятором в этой электрохимической «батарейке»: через нее ионы не проходят. Разность потенциалов создается другими сложными механизмами в конечном счете из «сжигания» сахара в кислороде. Ион водорода H + втягивается во «впускной коллектор» и присоединяется к белковой дольке ротора. Ротор поворачивается за счет электростатических сил, а долька, достигшая «выхлопного коллектора» мотора, освобождается от иона каталитическим белком, и этот ион проваливается внутрь клетки, опять же за счет электростатических сил, стремящихся выровнять потенциал по обе стороны мембраны. Таким образом, электроэнергия сначала превращается в механическую энергию вращения молекулярного вала, присоединенного к ротору и уходящего вглубь клетки, к механизму синтеза, F1.
Механико-химический реактор F1 состоит из трех белковых долек, каждая из которых состоит из двух белковых молекул (их называют α-F1 и β-F1, а вал сделан из одной молекулы, обозначаемой γ-F1). Каждая долька может принимать две устойчивые пространственные конфигурации за счет взаимного межатомного притяжения - как обычный настенный выключатель оказывается в двух устойчивых положениях, хотя промежуточные положения неустойчивы. Одно из этих положений, однако, имеет более высокую энергию. Молекулы сдвигаются в конфигурацию с более высокой энергией за счет асимметрии вращающегося γ-вала, как будто бы «кулачком» на нем.
Когда к αβ-комплексу присоединяется АДФ и ион фосфата, равновесие нарушается, и молекула, как пружинка с запасенной энергией, перепрыгивает в состояние с меньшей энергией, а запасенная энергия тратится на сближение АДФ и фосфатного иона, в результате чего те соединяются в молекулу АТФ, в конечном счете уносящую этот запас энергии.
Вращение механизма можно увидеть в микроскоп, если присоединить к ротору в F0 специально изготовленную длинную светящуюся (флюоресцирующую) молекулу-стержень. В самом конце фильма можно увидеть реконструкцию этого потрясающего опыта Масасуке Ёсиды и врезку с данными, показывающими вращение ротора.
Интересно, что на нижнем конце ротора имеется еще один белок, δ-F1, который тоже умеет изменять конфигурацию в присутствии АДФ, исходного реагента для реакции. Когда АДФ вокруг реактора оказывается мало, этот белок меняет форму и заклинивает ротор, чтобы не расходовать электрохимическую энергию вхолостую, поскольку продвижение ионов H + через остановленный ротор невозможно.
2.2. Регуляция потоков восстановительных эквивалентов
Если два пути окисления: свободный и энергетически сопряженный- сосуществуют в одной и той же клетке, возникает проблема, как предотвратить утилизацию всех восстановительных эквивалентов по тому из них, который термодинамически более выгоден. Без сомнения, пространственное разграничение (компартментализация) метаболических процессов играет ведущую роль в решении этой проблемы. Так, например, дегидрогеназы основных субстратов локализованы в матриксе, так что восстановительные эквиваленты, питающие дыхательную цепь, образуются непосредственно внутри митохондрий и потому сами по себе недоступны для внешних систем свободного окисления. Кроме того, во внутренней митохондриальной мембране содержится несколько АцН-зависимых переносчиков, ответственных за аккумуляцию в матриксе тех субстратов, чьи дегидрогеназы имеются не только в митохондриях, но и в цитозоле. Если же дегидрогеназа данного субстрата локализована исключительно в цитозоле, то используются особые челночные механизмы, переносящие восстановительные эквиваленты из цитозоля в матрикс.
малат-аспартат-глутаматный челнок.
Действие этой системы приводит к окислению внемитохондриального НАДН посредством НАД+-матрикса. В процессе участвуют два фермента, локализованные по обе стороны внутренней мембраны митохондрий, а именно малатдегидрогеназа и аспартат: глутама-таминотрансфераза. Кроме того, необходимы два переносчика: антипортер дикарбоновых кислот и глутамат/аспартат-антипортер. Последний использует энергию AjiH, так как он катализирует обмен аспартат 2 -/ (глутамат 2_ +Н +). В результате перенос гидрид-иона от НАДН+нар к НАД+вн оказывается сопряженным с перемещением одного иона Н + из цитозоля в матрикс.
Другой челночный механизм использует две глицерофосфатдегидрогеназы: цитозольную, зависящую от НАД, и митохондриаль-ную, восстанавливающую KoQ
без участия НАД. Челночные системы тканеспецифичны. Например, малатный челнок очень активен в печени, но отсутствует в сердце, где митохондрии лишены дикарбоксилатного антипортера. Глицерофосфатный челнок
резко активизируется тиреоидными гормонами.
Другим примером пространственного разделения окислительного обмена могут быть пероксисомы.
Эти органеллы окружены мембраной, напоминающей по проницаемости внешнюю митохондриальную мембрану. Она не проницаема для белков, но легко пропускает низкомолекулярные вещества. Поглощение кислорода пероксисомами обусловлено действием уратоксидазы, оксидазы D-аминокислот и оксидазы а-оксикислот. Оксидазы пероксисом не конкурируют с ферментами сопряженного дыхания митохондрий, поскольку субстраты этих оксид аз окисляются без участия НАД(Ф) и дыхательной цепи. Токсический продукт реакции - пероксид водорода - немедленно разлагается внутри пероксисом каталазой, самым массовым белком этих органелл.
3.1. Н+-Пирофосфатсинтаза
В 1966 г. М. Балчевски и сотрудники описали образование неорганического пирофосфата хроматофорами Rhodospirillum rubrum
под действием света. Позднее было найдено, что в темноте пирофосфат, подобно АТФ, энергизует мембрану хроматофоров. Опыты в группе автора показали, что гидролиз пирофосфата генерирует Агр на мембране хроматофоров, а также протеолипосом, содержащих очищенную пирофосфатазу Rh. rubrum.
Затем Р. Нирен и М. Балчевски сообщили о синтезе АТФ за счет энергии гидролиза пирофосфата протеолипосомами, содержащими пирофосфатазу и Н+-АТФ-синтазу из Rh. rubrum.
Протонофоры блокировали процесс. В хроматофорах был показан протонный контроль пирофосфатазной активности, которая возрастала в восемь раз при рассеянии ЛрН.
Перечисленные данные представляются достаточными для заключения, что мембранная пирофосфатаза хроматофоров Rh. rubrtim обладает активностью Н + -насоса,
катализируя обратимое взаимопревращение энергии между ДцН и пирофосфатом. Следовательно, данный фермент может быть определен как Н+-пирофосфатсинтаза.
Механизм действия фермента и его молекулярные свойства остаются неясными. Известен лишь набор ингибиторов, подавляющих пирофосфатазную активность как мембранной, так и растворимой формы фермента. Это фторид, имидодифосфат, N-этилмалеимид и антибиотик Дио-9. Олигомицин не влияет на фермент. ДЦКД снижает активность пирофосфатазы в хроматофорах, но не в растворе и не в протеолипосомах. Образование А-ф протеолипосомами чувствительно к ДЦКД.
Казалось бы, функцией Н+-пирофосфатсинтазы в клетках Rh. rubrum
должен быть синтез пирофосфата за счет энергии света (или
дыхания) либо генерация АцН за счет гидролиза пирофосфата. Однако в первом случае не ясна дальнейшая судьба образованного пирофосфата, который в клетках обычного типа расщепляется растворимой пирофосфатазой. Последнее необходимо, чтобы удерживать концентрацию пирофосфата на низком уровне и тем самым стимулировать АТФ-зависимые биосинтезы, сопровождающиеся образованием пирофосфата. Существуют, правда, исключения из правила о том, что пирофосфат немедленно расщепляется растворимой пирофосфатазой. У некоторых бактерий описан целый ряд синтетических процессов, утилизирующих энергию пирофосфата. Быть может, Rh. rubrum
относится именно к этой категории микроорганизмов. В любом случае Н+-пирофосфат-синтазаRh. rubrum
должна обладать важной биологической функцией. Ее активность в хроматофорах очень велика и соизмерима с таковой Н + -АТФ-синтазы.
Неожиданно высокая концентрация пирофосфата была обнаружена в клетках растений. У растений Н+-пирофосфатаза найдена в тонопласте и мембранах аппарата Гольджи.
3.2. Контроль протонного потенциала у бактерий у бактерий
Как уже отмечалось, многие бактерии располагают параллельными электрон-транспортными путями, одни из которых сопряжены с накоплением энергии, а другие - нет. Кроме того, свободное и сопряженное окисления могут быть последовательно включены в одну и ту же дыхательную цепь. Проблему «полезного разобщения» никогда не исследовали применительно к бактериям.
Интересный пример механизма, поддерживающего высокую ДцН по принципу саморегуляции, был выявлен в опытах с подвижными бактериями. Показано, что искусственно вызванные изменения ДцН воспринимаются бактерией как сигнал, регулирующий ее движение. Так, добавка разобщителя или исчерпание кислорода служат репеллентным сигналом, вызывающим изменение направления движения бактерии. Соответственно добавление Ог оказывается аттрактантным стимулом, благоприятным для линейного движения. Отмечено, что влияние кислорода на поведение бактерий (аэротаксис) проявляется лишь в тех случаях, когда концентрация Ог в среде влияет на ДрН.
Простейшее объяснение этих данных состоит в том, что бактерия располагает устройством, которое измеряет
протонный потенциал и посылает соответствующий сигнал флагеллярному мотору,
регулируя таким
способом направление вращения_ жгутика: направление изменяется на противоположное, если Др,Н снижается, и сохраняется неизменным, если она растет. В результате клетка движется туда, где она может поддерживать более высокую Др,Н. Гипотетический механизм подобного типа, названный автором протометром,
позволяет интегрировать множество благоприятных и неблагоприятных воздействий, отражающихся на энергетическом состоянии мембран.
Описан механизм, согласующий работу двух фотосистему хлоропластах и тем самым оптимизирующий продукцию Др,Н и НАДФН. Если фотосистема II работает слишком быстро, это приводит к восстановлению редокс-переносчика (предположительно PQ),
включенного между двумя фотосистемами. Такой эффект некоторым способом активирует протеинкиназу, фосфорилирующую белок, который несет на себе хлорофилл антенны. Названный белок в его нефосфорилированном состоянии локализуется в основном в тилакоидах, упакованных в граны. Фосфорилирование увеличивает отрицательный заряд белков антенны, которые диффундируют из тилакоидов в мембраны стромы, где, как правило, локализована фотосистема I. В итоге фотосистема I получает больше хлорофилла антенны, а следовательно, и больше фотонов, чем фотосистема II. Активация фотосистемы I вызывает окисление PQH2, а значит, и торможение протеинкиназы. Непрерывно действующая протеинфосфатаза дефосфорилирует белок антенны и прекращает его дальнейшую утечку из тилакоидов в ламеллы стромы.
5.1. Осмотическая работа
(Na+, метаболит)-симпортеры. У алкалотолерантной V. algino-lyticus,
располагающей Ыа+-НАДН-хинонредуктазой, обнаружены (Na + , метаболит)-симпортеры, ответственные за аккумуляцию 19 аминокислот и сахарозы.
Показано также, что накопление К + в клетках V. alginolyticus
при щелочных рН поддерживается энергией Aif>, генерируемой Na + -НАДН-хинонредуктазой. Nа+-Зависимое накопление метаболитов в алкалофильных бациллах было описано в ряде сообщений. Однако остается неясным, как эти алкалофилы образуют Ajj,Na.
Нейтрофнльные бактерии, живущие при низких или умеренных концентрациях NaCl, обычно используют Н+, а не Na+ в качестве симпортируемого иона. Однако известны и исключения из этого правила. Так, пролин
транспортируется вместе с Na+ в клетки Mycobacterium phlei, Salmonella typhimurium
и E. coli.
Интересный «дуалистический» механизм импорта метаболита описан у Е. coli.
Оказалось, что эта бактерия использует альтернативно Н+ или Na+ в качестве сопрягающего катиона при аккумуляции мелибиозы.
Поглощение цитрата бактериями Klebsiella pneumoniaeосуществляется
переносчиком, обеспечивающим симпорт цитрата 3- , 2Na + и 2Н+. Это означает, что движущей силой процесса должны быть Аг|э, pNa и ДрН.
А. Броди и сотрудникам удалось выделить (Na+, пролин)-сим-портер из М. phlei,
который оказался белком массой в 20 кДа. Очищенный симпортер был реконструирован с фосфолипидами. Полученные протеолипосомы транспортировали пролин за счет Агр, образованной диффузией ионов К + . Аккумуляция пролина тормозилась протонофорами, снижавшими Дг|>, а также сульфгидриль-ными реагентами.
Описана также частичная очистка и реконструкция (Na+, acпартат)-симпортера из галофильной Halobacterium halobium.
Вообще морские и галофильные микроорганизмы, подобно алкалофильным, обычно используют Na + , а не Н+ как симпортируемый ион.
Это верно также и для внешней мембраны клеток высших животных, омываемой раствором с высокой концентрацией NaCl. Данное обстоятельство - еще одно свидетельство справедливости мнения о том, что кровь - «частичка океана в теле человека». Генераторами AjiNa на плазмалемме животных клеток служит Na+/K + -ATOa3a (в некоторых случаях также и Ыа+-АТФаза). Образованная AjiNa утилизируется различными переносчиками, транспортирующими в клетку аминокислоты, сахара, жирные кислоты и другие соединения. Ряд (Na+, метаболит)-симпортеров выделен и встроен в протеолипосомы.
Некоторые животные клетки содержат Н+-АТФазу во внешней мембране. В этих клетках также найдены (Н+, метаболит) -симпортеры.
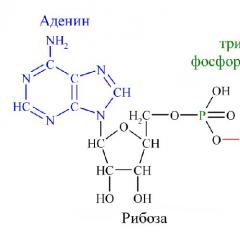
Аденозинтрифосфорная кислота-АТФ - обязательный энергетический компонент любой живой клетки. АТФ также нуклеотид, состоящий из азотистого основания аденина, сахара рибозы и трех остатков молекулы фосфорной кислоты. Это неустойчивая структура. В обменных процессах от нее последовательно отщепляются остатки фосфорной кислоты путем разрыва богатой энергией, но непрочной связи между вторым и третьим остатками фосфорной кислоты. Отрыв одной молекулы фосфорной кислоты сопровождается выделением около 40 кДж энергии. В этом случае АТФ переходит в аденозиндифосфорную кислоту (АДФ), а при дальнейшем отщеплении остатка фосфорной кислоты от АДФ образуется аденозинмонофосфорная кислота (АМФ).
Схема строения АТФ и превращения ее в АДФ (Т.А. Козлова, В.С. Кучменко. Биология в таблицах. М.,2000)
Следовательно, АТФ - своеобразный аккумулятор энергии в клетке, который "разряжается" при ее расщеплении. Распад АТФ происходит в процессе реакций синтеза белков, жиров, углеводов и любых других жизненных функций клеток. Эти реакции идут с поглощением энергии, которая извлекается в ходе расщепления веществ.
АТФ синтезируется в митохондриях в несколько этапов. Первый из них - подготовительный - протекает ступенчато, с вовлечением на каждой ступени специфических ферментов. При этом сложные органические соединения расщепляются до мономеров: белки - до аминокислот, углеводы - до глюкозы, нуклеиновые кислоты - до нуклеотидов и т. д. Разрыв связей в этих веществах сопровождается выделением небольшого количества энергии. Образовавшиеся мономеры под действием других ферментов могут претерпеть дальнейший распад с образованием более простых веществ вплоть до диоксида углерода и воды.
Схема Синтез АТФ в мвтохондрии клетки
ПОЯСНЕНИЯ К СХЕМЕ ПРЕВРАЩЕНИЕ ВЕЩЕСТВ И ЭНЕРГИИ В ПРОЦЕССЕ ДИССИМИЛЯЦИИ
I этап - подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия.
Белки ->аминокислоты
Жиры->
глицерин и жирные кислоты
Крахмал ->глюкоза
II этап-гликолиз (бескислородный): осуществляется в гиалоплазме, с мембранами не связан; в нем участвуют ферменты; расщеплению подвергается глюкоза:
У дрожжевых грибов молекула глюкозы без участия кислорода превращается в этиловый спирт и диоксид углерода (спиртовое брожение):
У других микроорганизмов гликолиз может завершаться образованием ацетона, уксусной кислоты и т, д. Во всех случаях распад одной молекулы глюкозы сопровождается образованием двух молекул АТФ. В ходе бескислородного расщепления глюкозы в виде химической связи в молекуле АТФ сохраняется 40% анергии, а остальная рассеивается в виде теплоты.
III этап-гидролиз (кислородный): осуществляется в митохондриях, связан с матриксом митохондрий и внутренней мембраной, в нем участвуют ферменты, расщеплению подвергается молочная кислота: СзН6Оз+ЗН20 -->3СО2+ 12Н. С02 (диоксид углерода) выделяется из митохондрий в окружающую среду. Атом водорода включается в цепь реакций, конечный результат которых - синтез АТФ. Эти реакции идут в такой последовательности:
1. Атом водорода Н с помощью ферментов-переносчиков поступает во внутреннюю мембрану митохондрий, образующую кристы, где он окисляется: Н-е-->H+
2. Протон водорода H+
(катион) выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана непроницаема, поэтому они накапливаются в межмембранном пространстве, образуя протонный резервуар.
3. Электроны водорода e переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород (анион): O2 + е-->O2-
4. Катионы и анионы по обе стороны мембраны создают разноименно заряженное электрическое поле, и когда разность потенциалов достигнет 200 мВ, начинает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетаз, которые встроены во внутреннюю мембрану, образующую кристы.
5. Через протонный канал протоны водородаH+
устремляются внутрь митохондрий, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и Ф (АДФ+Ф-->АТФ), а протоны H+
взаимодействуют с активным кислородом, образуя воду и молекулярный 02:
(4Н++202- -->2Н20+02)
Таким образом, О2, поступающий в митохондрии в процессе дыхания организма, необходим для присоединения протонов водорода Н. При его отсутствии весь процесс в митохондриях прекращается, так как электронно-транспортная цепь перестает функционировать. Общая реакция III этапа:
(2СзНбОз + 6Oз + 36АДФ + 36Ф ---> 6С02 + 36АТФ + +42Н20)
В результате расщепления одной молекулы глюкозы образуются 38 молекул АТФ: на II этапе - 2 АТФ и на III этапе - 36 АТФ. Образовавшиеся молекулы АТФ выходят за пределы митохондрии и участвуют во всех процессах клетки, где необходима энергия. Расщепляясь, АТФ отдает энергию (одна фосфатная связь заключает 40 кДж) и в виде АДФ и Ф (фосфата) возвращается в митохондрии.
В биологии АТФ - это источник энергии и основа жизни. АТФ - аденозинтрифосфат - участвует в процессах метаболизма и регулирует биохимические реакции в организме.
Что это?
Понять, что такое АТФ, поможет химия. Химическая формула молекулы АТФ - C10H16N5O13P3. Запомнить полное название несложно, если разбить его на составные части. Аденозинтрифосфат или аденозинтрифосфорная кислота - нуклеотид, состоящий из трёх частей:
- аденина - пуринового азотистого основания;
- рибозы - моносахарида, относящегося к пентозам;
- трёх остатков фосфорной кислоты.

Рис. 1. Строение молекулы АТФ.
Более подробная расшифровка АТФ представлена в таблице.
АТФ впервые обнаружили гарвардские биохимики Суббарао, Ломан, Фиске в 1929 году. В 1941 году немецкий биохимик Фриц Липман установил, что АТФ является источником энергии живого организма.
Образование энергии
Фосфатные группы соединены между собой высокоэнергетическими связями, которые легко разрушаются. При гидролизе (взаимодействии с водой) связи фосфатной группы распадаются, высвобождая большое количество энергии, а АТФ превращается в АДФ (аденозиндифосфорную кислоту).
Условно химическая реакция выглядит следующим образом:
ТОП-4 статьи которые читают вместе с этой
АТФ + Н2О → АДФ + Н3РО4 + энергия

Рис. 2. Гидролиз АТФ.
Часть высвободившейся энергии (около 40 кДж/моль) участвует в анаболизме (ассимиляции, пластическом обмене), часть - рассеивается в виде тепла для поддержания температуры тела. При дальнейшем гидролизе АДФ отщепляется ещё одна фосфатная группа с высвобождением энергии и образованием АМФ (аденозин-монофосфата). АМФ гидролизу не подвергается.
Синтез АТФ
АТФ располагается в цитоплазме, ядре, хлоропластах, в митохондриях. Синтез АТФ в животной клетке происходит в митохондриях, а в растительной - в митохондриях и хлоропластах.
АТФ образуется из АДФ и фосфата с затратой энергии. Такой процесс называется фосфорилированием:
АДФ + Н3РО4 + энергия → АТФ + Н2О

Рис. 3. Образование АТФ из АДФ.
В растительных клетках фосфорилирование происходит при фотосинтезе и называется фотофосфорилированием. У животных процесс протекает при дыхании и называется окислительным фосфорилированием.
В животных клетках синтез АТФ происходит в процессе катаболизма (диссимиляции, энергетического обмена) при расщеплении белков, жиров, углеводов.
Функции
Из определения АТФ понятно, что эта молекула способна давать энергию. Помимо энергетической аденозинтрифосфорная кислота выполняет другие функции:
- является материалом для синтеза нуклеиновых кислот;
- является частью ферментов и регулирует химические процессы, ускоряя или замедляя их протекание;
- является медиатором - передаёт сигнал синапсам (местам контакта двух клеточных мембран).
АТФ-синтаза — фермент (КФ 3.6.3.14), который осуществляет реакцию синтеза АТФ из АДФ и аниона фосфата обычно за счет энергии трансмембранного электрохимического потенциала протонов (то есть комбинации градиента протонов и электрического напряжения), а в некоторых организмов за счет электрохимического потенциала ионов натрия, превращая ее, таким образом, в энергию химических связей, которая затем может использоваться клеткой в биохимических реакциях. В случае, когда фермент проводит обратный процесс — формирует трансмембранный протонный градиент за счет гидролиза АТФ, его могут называть АТФазы. Действие фермента ингибирует антибиотик олигомицин.
Номенклатура
АТФ-синтаза F 1 F 0 состоит из двух субъединиц:
- F 0 мембранная часть комплекса
- F 1 часть комплекса в матриксе митохондрий или цитоплазме бактерий.
Номенклатура субъединиц АТФ-синтазы достаточно сложная и имеет долгую историю. F 1 -фракции получила свое название от срока fraction 1 («фракция 1»), а F 0 (первоначально писалась с индексом «O», а не «ноль», как это более принято сейчас) получила название как фракция, н "связывает олигомицин.
По примеру других ферментов, большинство субъединиц получили названия в виде греческих (от α до ε) и латинских (от a до h) букв. Остальные субъединиц получили сложные названия:
- F 6 (от fraction 6)
- OSCP (oligomycin sensitivity conferral protein — «вспомогательной белок чувствительности к олигомицину»)
- A6L (названный по названию гена генома митохондрий, кодирующего эту субъединицу)
- IF1 (inhibitory factor 1 — «ингибирующее фактор 1»)
Устройство и принцип работы
АТФ-синтаза располагается на одной из мембран клетки и состоит из погруженного в нее домена F 0 и выступающего в матрикс или цитоплазму домена F 1, соединенных субъединицей γ. Отдаленно фермент напоминает плодовое тело гриба (в связи с чем в литературе по клеточной биологии, особенно старой, АТФ-синтазу иногда называли «грибовидными телом»).
Комплекс F 1 имеет диаметр около 9-10 нм и при разрушении γ «ножки» может отделяться от мембраны, образуя т F 1 -АТФазу. F 1 состоит из трех субъединиц α и трех β, которые объединяются попарно и формируют гексамеров с тремя активными центрами. Конформации меняются при вращении субъединицы γ вместе с комплексом F 0. Движущей силой в этом процессе переноса протона, что катализирует доменом F 0. Таким образом, протон напрямую не участвует в реакции конденсации АДФ и аниона фосфата. Следует отметить, что сам α 3 β 3 гексамеров не вращается относительно «статора» a, поскольку он содержится субъединицей δ, в свою очередь связанной с a субъединицей b («стеблем») комплекса F 1 (хотя обычно F 1 рассматривается как неподвижный, в действительности оба комплекса вращаются относительно друг друга в противоположных направлениях).
Принцип работы комплекса F 1 состоит сначала в слабом связывании АДФ и фосфата с активным центром, который затем меняет конформацию и прочно связывает их, в результате чего синтез АТФ идет самопроизвольно. При третьей конформации АТФ выталкивается из активного центра.
Принцип работы комплекса F 0 (что часто называют «самым маленьким в мире роторным электромотором») заключается в проникновении протона через канал в «статоре» (субъединица a) до связывания в «Ротор» (c-кольце). Для освобождения на другой стороне мембраны протона нужно выйти через другой канал в статоре, что сдвинут на некоторое расстояние, то есть для выхода ротора НЕОБХОДИМО обернуться относительно статора. Таким образом в роторе создается горизонтальная разность потенциалов, вращает его относительно статора.
Физиологическая роль
В роли АТФазы фермент применяется анаеробними бактериями для создания за счет энергии АТФ трансмембранного электрохимического потенциала протонов. Этот градиент, в свою очередь, используется для вращения жгутиков и для транспорта ионов внутрь клетки.
В аэробных бактерий фермент в основном используется для синтеза АТФ, причем электрохимического потенциал для этого производится при функционировании дыхательная цепь переноса электронов. В целом данный процесс называется окислительным фосфорилированием. Он протекает в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причем F 1 субъединица находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
АТФ-синтеза задействована также в процессе фотосинтеза; она локализуется на тилакоидних мембранах хлоропластов, ориентируясь F 1 субъединицы в строму. Строение и механизм работы фермента в этом случае практически идентичен таковым для АТФ-синтазы митохондрий, однако протонный электрохимический потенциал формируется в принципиально ином электронтранспортной цепи.