Алкены химические свойства таблица. Алкены — Гипермаркет знаний
Для алкенов характерны, прежде всего, реакции присоединения по двойной связи. В основном эти реакции идут по ионному механизму. Пи-связь разрывается, и образуются две новые сигма-связи. Напомню, что для алканов типичными были реакции замещения и шли они по радикальному механизму. Присоединяться к алкенам могут молекулы водорода, эти реакции называются гидрирование, молекулы воды, гидратация, галогены галогенирование, галогенводороды гидрогалогенирование. Но обо всем по порядку.
Реакции присоединения по двойной связи
Итак, первое химическое свойство способность присоединять галогеноводороды, гидрогалогенирование.
Пропен и остальные алкены реагируют с галогеноводородами по правилу Марковникова.

Атом водорода присоединяется к наиболее гидрированному, или правильнее сказать гидрогенизированному, атому углерода.
Вторым номером в нашем списке свойств будет гидратация, присоединение воды.
Реакция проходит при нагревании в присутствии кислоты обычно серной или фосфорной. Присоединение воды происходит также по правилу Марковникова, то есть первичный спирт можно получить только гидратацией этилена, остальные неразветвленные алкены дают вторичные спирты.
И для гидрогалогениерования и для гидратации существуют исключения из правила Марковникова. Во-первых, против этого правила присоединение протекает в присутствии пероксидов.
Во-вторых, для производных алкенов, в которых присуствуют электронноакцепторне группы. Например, для 3,3,3-трифторпропена-1.

Атомы фтора за счет высокой электроотрицательности оттягивают на себя электронную плотность по цепи сигма-связей. Такое явление называется отрицательным индуктивным эффектом.

Из-за этого происходит смещение подвижных пи-электронов двойной связи и у крайнего атома углерода оказывается частичный положительный заряд, который обычно обозначается как дельта плюс. Именно к нему и пойдет отрицательно заряженный ион брома, а катион водорода присоединится к наименее гидрированному атому углерода.
Помимо трифторметильной группы отрицательным индуктивным эффектом обладает, например, трихлорметильная группа, нитрогруппа, карбоксильная группа и некоторые другие.
Этот второй случай нарушения правила Марковникова в ЕГЭ встречается очень редко, но все-таки желательно иметь его в виду, если вы планируете сдать экзамен на максимальный балл.
Третье химическое свойство присоединение молекул галогенов.

В первую очередь это касается брома, поскольку данная реакция является качественной на кратную связь. При пропускании, например, этилена через бромную воду, то есть раствор брома в воде, имеющий коричневый цвет, происходит ее обесцвечивание. Если пропускать через бромную воду смесь газов, например, этан и этен, то можно получить чистый этан без примеси этена, поскольку тот останется в реакционной колбе в виде дибромэтана, представляющего собой жидкость.
Особым образом стоит отметить реакцию алкенов в газовой фазе при сильном нагревании, например, с хлором.
При таких условиях протекает не реакция присоединения, а реакция замещения. При чем исключительно по альфа-атому углерода, то есть атому, соседствующему с двойной связью. В данном случае получается 3-хлорпропен-1. Эти реакции на экзамене встречаются нечасто, поэтому большинство учеников их не помнит и, как правило, совершает ошибки.
Четвертым номером идет реакция гидрирования, а вместе с ней и реакция дегидрирования. То есть присоединение или отщепление водорода.

Гидрирование происходит при не очень высокой температуре на никелевом катализаторе. При более высокой температуре возможно дегидрирование с получением алкинов.
Пятым свойством алкенов является способность к полимеризации, когда сотни и тысячи молекул алкена за счет разрыва пи-связи и образования сигма-свзяей друг с другом образуют очень длинные и прочные цепочки.
В данном случае получился полиэтилен. Обратите внимание, что в получившейся молекуле кратные связи отсутствуют. Такие вещества называются полимерами, исходные молекулы называются мономерами, повторяющийся фрагмент это элементарное звено полимера, а число n степень полимеризации.
Также возможны реакции получения других важных полимерных материалов, например, полипропилена.


Еще один важный полимер поливинилхлорид.

Исходным веществом для производства этого полимера является хлорэтен, тривиальное название которого винилхлорид. Поскольку этот непредельный заместитель называется винил. Часто встречающаяся аббревиатура на пластмассовых изделиях ПВХ как раз расшифровывается как поливинилхлорид.
Мы обсудили пять свойств, которые представляли собой реакции присоединения по двойной связи. Теперь обратимся к реакциям окисления .
Реакции окисления алкенов
Шестое химическое свойство в нашем общем списке это мягкое окисление или реакция Вагнера. Оно протекает при воздействии на алкен водным раствором перманганата калия на холоду, поэтому часто в экзаменационных заданиях указывают температуру ноль градусов.
В результате получается двухатомный спирт. В данном случае этиленгликоль, а в целом такие спирты носят общее название гликоли. В процессе реакции фиолетово-розовый раствор перманганата обесцвечивается, поэтому эта реакция также является качественной на двойную связь. Марганец в нейтральной среде из степени окисления +7 восстанавливается до степени окисления +4. Рассмотрим еще несколько примеров. УРАВНЕНИЕ
Здесь получился пропандиол-1,2. Однако таким же образом будут реагировать и циклические алкены. УРАВНЕНИЕ
Еще один вариант, когда двойная связь находится, например, в боковой цепи ароматических углеводородов. Регулярно в заданиях егэ встречается реакция Вагнера с участием стирола, его второе название винилбензол.

Я надеюсь, что представил вашему вниманию достаточно примеров, чтобы вы поняли, что мягкое окисление двойной связи всегда подчиняется довольно простому правилу пи-связь разрывается и к каждому атому углерода присоединяется гидроксигруппа.
Теперь, что касается жесткого окисления. Это будет наше седьмое свойство. Такое окисление происходит, когда алкен реагирует с кислотным раствором перманганата калия при нагревании.
Происходит деструкция молекулы, то есть ее разрушение по двойной связи. В случае бутена-2 получились две молекулы уксусной кислоты. В целом же, по продуктам окисления можно судить о положении кратной связи в углеродной цепи.
При окислении бутена-1 получается молекула пропионовой (пропановой) кислоты и углекислый газ.
В случае этилена получится две молекулы углекислого газа. Во всех случаях в кислой среде марганец из степени окисления +7 восстанавливается до +2.
И, наконец, восьмое свойство полное окисление или горение.
Алкены сгорают, как и другие углеводороды, до углекислого газа и воды. Запишем уравнение сгорания алкенов в общем виде.
Молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле алкена, поскольку в состав молекулы CO 2 входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа плюс n из воды, итого 3n. Слева атомов кислорода столько же, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть 3n/2 молекул кислорода. Можно записать 1,5n.
Мы рассмотрели восемь химических свойств алкенов.
НЕПРЕДЕЛЬНЫЕ, ИЛИ НЕНАСЫЩЕННЫЕ, УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА (АЛКЕНЫ, ИЛИ ОЛЕФИНЫ)
Алкены , или олефины (от лат. olefiant - масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены образуют гомологический ряд с общей формулой CnH2n
1. Гомологический ряд алкенов
Гомологи:
С H 2 = CH 2 этен
С H 2 = CH - CH 3 пропен
С H2=CH-CH2-CH3 бутен -1
С H2=CH-CH2-CH2- СН 3 пентен -1
Этилен (этен) - бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 - С4 (газы)
С5 - С17 (жидкости)
С18 - (твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
3. Простейшим алкеном является этилен - C2H4
Структурная и электронная формулы этилена имеют вид:
В молекуле этилена подвергаются гибридизации одна s - и две p -орбитали атомов C (sp 2-гибридизация).

Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p -орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
σ - связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s -орбиталями атомов H и также образуют четыре σ - связь. Две негибридные p -орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ - связь, т.е. образуется одна П - связь.


По своей природе П - связь резко отличается от σ - связь; П - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов П - связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака П - связь не разомкнулись.
4. Изомерия алкенов
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии - изомерия положения кратной связи и межклассовая изомерия .
Во-вторых, в ряду алкенов проявляется пространственная изомерия , связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис -транс -изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2СН3-СН=СН-СН3 группы СН3 могут находиться либо по одну сторону от двойной связи вцис -изомере, либо по разные стороны в транс -изомере.

ВНИМАНИЕ! цис-транс - Изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например,
бутен-1 СН2=СН-СН2-СН3 не имеет цис - и транс -изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н.
Изомеры цис - и транс - отличаются не только физическими
 ,
,
но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Иногда цис-транс -изомерию не совсем точно называют геометрической изомерией . Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис - и транс -.
5. Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н2С=СН—) винил или этенил
(Н2С=CН—СН2) аллил
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены) . Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены ), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов - алканов.
Строение алкенов
Ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название - олефины
- алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров - масел.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр 2 -гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Строение этилена

Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена ): С 2 Н 4 - этен, С 3 Н 6 - пропен, С 4 Н 8 - бутен, С 5 Н 10 - пентен, С 6 Н 12 - гексен, С 7 Н 14 - гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, - это бутен:

Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии - геометрической, или цис- и транс- изомерии .


Цис-изомеры
отличаются от транс-изомеров
пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
![]()
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.

3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен , обозначающий принадлежность соединения к классу алкенов. Например:

Физические свойства алкенов
Первые три представителя гомологического ряда алкенов - газы; вещества состава С5Н10 — С16Н32 - жидкости; высшие алкены - твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения
. Напомним, что отличительной чертой представителей непредельных углеводородов - алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения
.
1. Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов - платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция - дегидрирование.
2. Галогенирование (присоединение галогенов)
. Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода)
.
Эта реакция подчиняется
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген - к менее гидрированному.


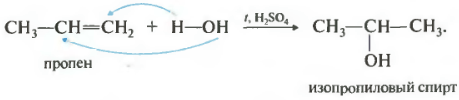
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты .

Эта реакция протекает также в соответствии с правилом Марковникова - катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа - к менее гидрированному.
5. Полимеризация.
Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение.
Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:




Простейшим алкеном является этен C 2 H 4 .По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.


Пространственная структура этилена
По названию первого представителя этого ряда - этилена - такие углеводороды называют этиленовыми.
Номенклатура и изомерия
Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан - этилен, пропан - пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан - алкен, этан - этен, пропан - пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:


Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н 2 С = СН - - винил (этенил)
Н 2 С = CН - СН 2 - -аллил (пропенил-2)
Изомерия
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Первые два члена гомологического ряда алкенов -(этилен и пропилен) - изомеров не имеют и их строение можно выразить так:
H 2 C = CH 2 этилен (этен)
H 2 C = CH - CH 3 пропилен (пропен)
Изомерия положения кратной связи
H 2 C = CH - CH 2 - CH 3 бутен-1
H 3 C - CH = CH - CH 3 бутен-2
Геометрическая изомерия - цис-, транс- изомерия.
Такая изомерия характерна для соединений с двойной связью.
Если простая σ -связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс- ) изомеров.
Геометрическая изомерия - один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами,а по разную - транс-изомерами:


Цис- и транс- изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс- изомеры более устойчивы, чем цис- изомеры.
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.
В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr 2 О 3).
Дегидрирование алканов
H 3 C - CH 2 - CH 2 - CH 3 → H 2 C = CH - CH 2 - CH 3 + H 2 (бутен-1)
H 3 C - CH 2 - CH 2 - CH 3 → H 3 C - CH = CH - CH 3 + H 2 (бутен-2)
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование ацетилена в присутствии катализатора (Pd):
H-C ≡ C-H + H 2 → H 2 C = CH 2
3. Дегидратация спиртов (отщепление воды).
В качестве катализатора используют кислоты (серную или фосфорную) или Аl 2 O 3:
В таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродною атома (правило А.М.Зайцева):

Физические свойства
Физические свойства некоторых алкенов показаны в таблице ниже. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) - газы, начиная с C 5 H 10 (амилен, или пентен-1) - жидкости, а с С 18 Н 36 - твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис -изомеров выше, чем транс -изомеров, а температуры плавления - наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо - в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Физические свойства некоторых алкенов
Название |
t пл,°С |
t кип,°С |
||
Этилен (этен) |
||||
Пропилен (пропен) |
||||
Бутилен (бутен-1) |
||||
Цис-бутен-2 |
||||
Транс-бутен-2 |
||||
Изобутилен (2-метилпропен) |
||||
Амилен (пентен-1) |
||||
Гексилен (гексен-1) |
||||
Гептилен (гептен-1) |
||||
Октилен (октен-1) |
||||
Нонилен (нонен-1) |
||||
Децилен (децен-1) |
Алкены малополярны, но легко поляризуются.
Химические свойства
Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью.
π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:

Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (с сохранением σ-связи).
Для алкенов, кроме присоединения, характерны еще реакции окисления и полимеризации.
Реакции присоединения
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды - алканы:
Н 2 С = СН 2 + H 2 → Н 3 С - СН 3 (этан)
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н 2 С = СН 2 + Cl 2 → ClH 2 C - CH 2 Cl (1,2-дихлорэтан)
Легче идет присоединение хлора и брома, труднее - иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.



Сравните: у алкенов реакция галогенирования - процесс присоединения, а не замещения (как у алканов).
Реакцию галогенирования обычно проводят в растворителе при обычной температуре.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.

Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р -орбиталь sp 2 -гибридизованного атома углерода перекрывается с р -орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.

На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic -рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение S N 2 у атома углерода, где уходящей группой является Br + .

Результат этой реакции нетрудно предвидеть: анион брома атакует карбкатион с образованием дибромэтана.
Быстрое обесцвечивание раствора брома в СCl 4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
Присоединение брома к алкенам (реакция бромирования) - качественная реакция на предельные углеводороды. При пропускании через бромную воду (раствор брома в воде) непредельных углеводородов желтая окраска исчезает (в случае предельных - сохраняется).
3. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогенводороды:
H 2 С = СН 2 + НВr → Н 3 С - CH 2 Вr
Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова (1837 - 1904): при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген - к менее гидрогенизированному:

Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Под влиянием метильной группы, связанной непосредственно с двойной связью, происходит смещение электронной плотности в сторону этой связи (на крайний углеродный атом).
Вследствие такого смещения p-связь поляризуется и на углеродных атомах возникают частичные заряды. Легко представить, что положительно заряженный ион водорода (протон) присоединится к атому углерода (электрофильное присоединение), имеющему частичный отрицательный заряд, а анион брома - к углероду с частичным положительным зарядом.
Такое присоединение является следствием взаимного влияния атомов в органической молекуле. Как известно, электроотрицательность атома углерода немного выше, чем водорода.
Поэтому в метильной группе наблюдается некоторая поляризация σ-связей С-Н, связанная со смещением электронной плотности от водородных атомов к углероду. В свою очередь это вызывает повышение электронной плотности в области двойной связи и особенно на ее крайнем, атоме. Таким образом, метильная группа, как и другие алкильные группы, выступает в качестве донора электронов. Однако в присутствии пероксидных соединений или О 2 (когда реакция имеет радикальный характер) эта реакция может идти и против правила Марковникова.
По тем же причинам правило Марковникова соблюдается при присоединении к несимметричным алкенам не только галогеноводородов, но и других электрофильных реагентов (H 2 O, H 2 SО 4 , НОСl, ICl и др.).
4. Гидратация (присоединение воды). В присутствии катализаторов к алкенам присоединяется вода с образованием спиртов. Например:
H 3 C - CH = CH 2 + H - OH → H 3 C - CHOH - CH 3 (изопропиловый спирт)
Реакции окисления
Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Горение
Н 2 С = СН 2 + 3O 2 → 2СO 2 + 2Н 2 O
2. Неполное каталитическое окисление

3. Окисление при обычной температуре. При действии на этилен водного раствора КМnO 4 (при нормальных условиях, в нейтральной или щелочной среде - реакция Вагнера) происходит образование двухатомного спирта - этиленгликоля:
3H 2 C = CH 2 + 2KMnO 4 + 4H 2 O → 3HOCH 2 - CH 2 OH (этиленгликоль)+ 2MnO 2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
В более жестких условиях (окисление КМnO 4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов:
H 3 C - CH = CH - CH 3 + 2O 2 → 2H 3 C - COOH (уксусная кислота)
Реакция изомеризации
При нагревании или в присутствии катализаторов алкены способны изомеризоваться - происходит перемещение двойной связи или установление изостроения.
Реакции полимеризации
За счет разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.

Нахождение в природе и физиологическая роль алкенов
В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений - этилен C 2 H 4 - является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов - мускалур (цис- трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica) .
Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей
Отдельные представители
Этилен (этен) - органическое химическое соединение,описываемое формулой С 2 H 4 . Является простейшим алкеном. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном (низкомолекулярные органические вещества, вырабатываемые растениями и имеющие регуляторные функции).
Этилен - вызывает наркоз, обладает раздражающим и мутагенным действием.
Этилен - самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3% в год.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения полиэтилена (1-е место, до 60 % всего объёма).
Полиэтилен - термопластичный полимер этилена. Самый распространенный в мире пластик.
Представляет собой воскообразную массу белого цвета (тонкие листы прозрачный бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80-120°С), при охлаждении застывает, адгезия (сцепление поверхностей разнородных твёрдых и/или жидких тел) - чрезвычайно низкая. Иногда в народном сознании отождествляется с целлофаном - похожим материалом растительного происхождения.
Пропилен - вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Со временем, происходит термостарение.
Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч).


Тара (бутылки, банки, ящики, канистры, садовые лейки, горшки для рассады.
Полимерные трубы для канализации, дренажа, водо-, газоснабжения.

Электроизоляционный материал.
Полиэтиленовый порошок используется как термоклей.

Бутен-2 - вызывает наркоз, обладает раздражающим действием.
НЕПРЕДЕЛЬНЫЕ, ИЛИ НЕНАСЫЩЕННЫЕ, УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА
(АЛКЕНЫ, ИЛИ ОЛЕФИНЫ)
Алкены , или олефины (от лат. olefiant - масло - старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, - жидкое маслянист вещество.) - алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой C n H 2n
1. Гомологический ряд алкенов
|
С n H 2 n алкен |
Названия, суффикс ЕН, ИЛЕН |
|
C 2 Н 4 |
этен , этилен |
|
C 3 H 6 |
пропен |
|
C 4 H 8 |
бутен |
|
C 5 H 10 |
пентен |
|
C 6 H 12 |
гексен |
Гомологи:
С H 2 = CH 2 этен
С H 2 = CH - CH 3 пропен
С H 2 =CH-CH 2 -CH 3 бутен -1
С H 2 =CH-CH 2 -CH 2 - СН 3 пентен -1
2. Физические свойства
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С 2 – С 4 (газы)
С 5 – С 17 (жидкости)
С 18 – (твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
3. Простейшим алкеном является этилен - C 2 H 4
Структурная
и электронная формулы этилена имеют вид:
В молекуле этилена подвергаются
гибридизации одна s
- и две p
-орбитали атомов C (sp
2 -гибридизация).
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p -орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
σ - связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s -орбиталями атомов H и также образуют четыре σ - связь. Две негибридные p -орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ - связь, т.е. образуется одна П - связь.

По своей природе П - связь резко отличается от σ - связь; П - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов П - связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака П - связь не разомкнулись.
4. Изомерия алкенов
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии - изомерия положения кратной связи и межклассовая изомерия .
Во-вторых, в ряду алкенов проявляется пространственная изомерия , связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С 4 Н 8):
2. Изомерия положения двойной связи (начиная с С 4 Н 8):
3. Межклассовая изомерия с циклоалканами, начиная с С 3 Н 6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис -транс -изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2 СН 3 –СН=СН–СН 3 группы СН 3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс -изомере.

ВНИМАНИЕ!
цис-транс
- Изомерия не проявляется, если хотя бы один из атомов С
при двойной связи имеет 2 одинаковых заместителя.
Например,
бутен-1 СН 2 =СН–СН 2 –СН 3 не имеет цис - и транс -изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н.
Изомеры цис - и транс - отличаются не только физическими
 ,
,
но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Иногда цис-транс -изомерию не совсем точно называют геометрической изомерией . Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис - и транс -.
5. Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан - этилен, пропан - пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан - алкен, этан - этен, пропан - пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н 2 С=СН-)винил или этенил
(Н 2 С=CН-СН 2) аллил



